
| A、我们可以根据硫酸密度的大小来判断铅蓄电池是否需要充电 |
| B、燃料电池是利用燃料和氧化剂之间的氧化还原反应,将化学能转化为热能,然后再转化为电能的化学电源 |
| C、普通锌锰干电池中,发生氧化还原反应的物质大部分被消耗后,就不能再使用了 |
| D、由Ag2O和Zn形成的碱性银锌纽扣电池,发生电化学反应时,Zn作为负极 |
| 放电 |
| 充电 |
| 放电 |
| 充电 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 甲组 | ①Al(OH)3 ②SiO2 ③FeCl3溶液 ④SO2 |
| 乙组 | a.NaOH溶液 b.浓HNO3 c.氨水 d.氯水 e.H2O2溶液 |
| A、① | B、② | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
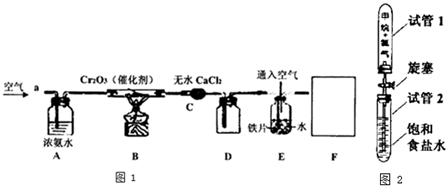
查看答案和解析>>
科目:高中化学 来源: 题型:
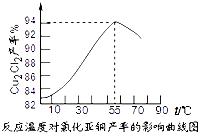 氯化亚铜(Cu2Cl2)是一种重要的化工产品,常用作有机合成催化剂.已知:
氯化亚铜(Cu2Cl2)是一种重要的化工产品,常用作有机合成催化剂.已知: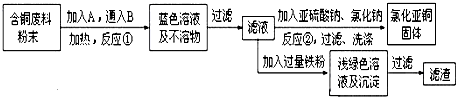
查看答案和解析>>
科目:高中化学 来源: 题型:
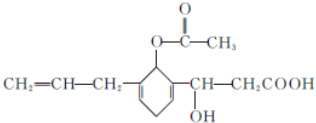

查看答案和解析>>
科目:高中化学 来源: 题型:
 针对化学反应中的能量变化解决下列问题.
针对化学反应中的能量变化解决下列问题.| 1 |
| 2 |
| CuO/CuCl2 |
| 400℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:
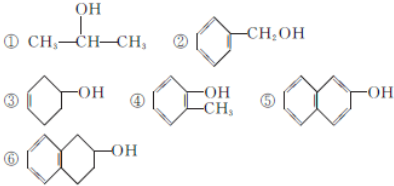
| A、①③④⑤ | B、②③⑥ |
| C、③④⑤⑥ | D、②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com