
| A. | 12.5% | B. | 14.3% | C. | 48.2% | D. | 87.5% |
分析 将铁、铝的混合物加入到足量的NaOH溶液中,参加反应的为Al,反应后固体为Fe;充分反应后过滤,再将过滤得到的固体加入到足量的CuSO4溶液中,充分反应后过滤得到的固体质量恰好与原固体质量相等,说明反应后生成的铜与混合物Fe和Al的质量相等,根据反应计算出混合物中铁的质量,然后计算出铁的质量分数,进而计算铝的质量分数,以此解答该题.
解答 解:假设原混合物质量为m克,所以经过两次反应后,最终得到的Cu的质量也是m克,设混合物中Fe的质量为xg,则:
Fe+CuSO4═FeSO4+Cu
56 64
x m
x=$\frac{56m}{64}$=$\frac{7m}{8}$,
即混合物中Fe的质量为$\frac{7m}{8}$g,
所以混合物中Fe的质量分数为:$\frac{\frac{7m}{8}}{m}$×100%=87.5%,
则Al的质量分数为1-87.5%=12.5%,
故选A.
点评 本题考查了混合物反应的计算,为高频考点,侧重考查学生的分析、计算能力,根据题干信息明确反应原理、得出反应生成铜的质量=m(Al)+m(Cu)为解答关键,注意把握好混合物计算的方法与技巧.


科目:高中化学 来源: 题型:选择题
| A. | 钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 铝粉投入到 NaOH 溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| C. | 铁粉与稀硫酸溶液反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Cl2 与烧碱溶液跟反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.8mL | B. | 2.4mL | C. | 3mL | D. | 4mL或1.2mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验步骤(简述操作过程) | 预期现象和结论 |
| ① ② ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
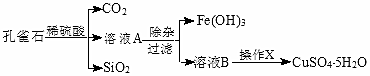
| 物质 | pH (开始沉淀) | pH④ (完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
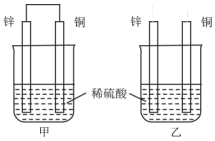 关于如图所示装置的叙述,正确的是( )
关于如图所示装置的叙述,正确的是( )| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 甲中电流由锌片经导线流向铜片 | D. | 两烧杯锌片均发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com