
某研究性学习小组为探究二氧化硫的还原性,查阅到如下资料:
资料卡 NO:2006—KI—001 主题:二氧化硫的还原性 ①课本上:向二氧化硫水溶液中滴加BaCl2溶液,再滴加0.5mL3%的过氧化氢溶液,振荡片刻后滴加稀盐酸,有白色沉淀生成 ②《无机化学》下册,P658:亚硫酸是较强的还原剂,可以将Cl2、I2、MnO4-还原为Cl-、I-、Mn2+,如: H2SO3+I2+H2O=H2SO4+2HI |
根据上述资料,请你参与以下探究:
(1)写出铜与浓硫酸反应的化学方程式_____________________________;
(2)把足量SO2通入适量的碘水中,可能观察到的现象是_____________________;
(3)证明SO2被氧化为SO42-所使用的试剂是______________;
(4)如果该探究小组想利用上述原理除去CO2中的SO2,并检验是否除尽,下列方案可行的是__(填字母)
A、将混合气体通过碘水,再通过品红溶液
B、将混合气体通过氯化钡和过氧化氢的混合溶液,再通过碘水溶液
C、将混合气体通过NaOH溶液,再通过品红溶液
D、将混合气体通过浓硫酸溶液,再通过品红溶液
(5)若该探究小组就上述实验提出,把含+4价硫元素化合物转化为含+6价硫元素化合物,下列试剂可以实现上述转化的是_______(填字母)
A、氧气 B、MnO4- C、氯气 D、浓硫酸
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:2015-2016学年河北省高二上12月月考化学试卷(解析版) 题型:选择题
下列说法正确的是 ( )。
A.凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体型
B.在SCl2中,中心原子S采取sp杂化轨道成键
C.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二上期中测试化学试卷(解析版) 题型:选择题
下列物质不能通过化合反应生成的是
A.NaOH B.NaHCO3 C.FeCl2 D.Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期第四次调研化学试卷(解析版) 题型:选择题
用CH4催化还原NO2可以消除氮氧化合物的污染,例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol.
下列说法中错误的是( )
A.等物质的量的CH4在反应①、②中转移电子数相同
B.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);△H>-574kJ/mol
C.4NO2(g)+2N2(g)=8NO(g);△H=+586kJ/mol
D.若用标准状况下4.48LCH4把NO2还原为N2,整个过程中转移的电子总数为1.6NA
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期第五次月考化学试卷(解析版) 题型:选择题
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是
后,使c、d两点短路.下列叙述正确的是

A.a为直流电源的负极 B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板 D.e极发生还原反应
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期12月质检化学试卷(解析版) 题型:选择题
下列表述不正确的是
A | B | C | D |
|
|
|
|
盐桥中的Cl-移向ZnSO4溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 粗铜的电极反应式为: Cu2++2e-=Cu | 正极反应式为: O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上期中测试化学试卷(解析版) 题型:填空题
某化学反应2A  B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 序号 | 时 间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。理由是
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高一上12月月考化学卷(解析版) 题型:填空题
Cu2S是一种灰黑色硫化物,不溶于水,能溶于硝酸。当溶于过量的一定浓度的硝酸时,生成Cu(NO3)2与CuSO4的混合溶液、NO气体和另一产物。
(1)写出该条件下反应的化学方程式: 。
(2)当有0.7 mol的SO42-生成时,该反应中转移的电子数为 。
(3)该反应中的氧化产物为 ,硝酸在该反应中体现了 (选填“氧化性”、“还原性”、“酸性”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上12月月考化学试卷(解析版) 题型:选择题
中科大陈乾旺教授等人发明人工合成金刚石的新方法,其化学原理为:
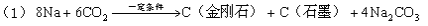
该法比1955年人工首次制得金刚石的方法容易得多,其化学原理是:
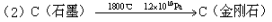
以下有关表述中正确的是
A.新法(1)利用的是化学变化,旧法(2)利用的是物理变化
B.在反应(1)中,利用了金属钠的还原性
C.在反应(1)中每生成12g金刚石需要消耗23g金属钠
D.在反应(1)和(2)中,金刚石都是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com