
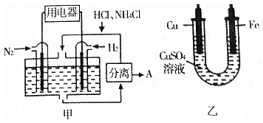
 如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.
如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.| A. | 通入H2-极与图乙中的铜电极相连 | |
| B. | 电池工作一段时间后,溶液pH减少1 | |
| C. | 当消耗0.025molN2时,则铁电极增重1.6g | |
| D. | 通入N2-端的电极反应式为:N2+8H++6e-═2NH4+ |
分析 图甲为原电池,负极失去电子发生氧化反应,则负极通入H2,正极得到电子发生还原反应,则正极通N2;图乙为电镀,目的是在铁上镀铜,则纯铜做阳极、Fe做阴极,即Cu与通入O2一极相连,Fe与通入H2一极相连,据此进行解答,
解答 解:图甲为原电池,负极失去电子发生氧化反应,则负极通入H2,正极得到电子发生还原反应,则正极通N2;图乙为电镀,目的是在铁上镀铜,则纯铜做阳极、Fe做阴极,即Cu与通入O2一极相连,Fe与通入H2一极相连,
A.图乙中的铜电极为阳极,与原电池的正极相连,即通入H2一极与图乙中的Fe电极相连,故A错误;
B.电池工作过程中生成氨气,氨气消耗氢离子,导致溶液的pH增大,故B错误;
C.消耗0.025molN2转移电子的物质的量为:0.25mol×(3×2)=0.15mol,根据电子守恒生成铜的物质的量为$\frac{0.15mol}{2}$=0.075mol,则Fe电极增重质量为64g/mol×0.075mol=4.8g,故C错误;
D.通入N2一端为正极,正极氮气得到电子与氢离子结合生成铵根离子,其电极反应式为:N2+8H++6e-═2NH4+,故D正确;
故选D.
点评 本题考查原电池、电解池工作原理,题目难度中等,正确判断两极为解答关键,注意熟练掌握原电池、电解池工作原理,C为易错点,注意电子守恒的应用,试题培养了学生的灵活应用能力.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷的球棍模型: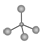 | B. | 羟基的电子式: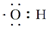 | ||
| C. | 乙醛的结构式:CH3CHO | D. | (CH3)3COH的名称:2,2二甲基乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应前O2的体积为560 mL | B. | 化合物XY3的摩尔质量为86 g/mol | ||
| C. | XY3的质量为0.99g | D. | 反应后气体总质量约为1.79 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(mim) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(ML) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠露置在空气中,光亮表面颜色变暗:4Na+O2═2Na2O | |
| B. | 铝条插入烧碱溶液中,开始没有明显现象:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 硫酸铵溶液与氢氧化钡溶液混合,产生气体:NH4++OH-═NH3↑十+H2O | |
| D. | 碘化银悬浊液滴加硫化钠溶液,黄色沉淀变成黑色:2AgI+S2-═Ag2S↓+2I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氢氧化亚铁中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 向 NaClO 溶液中通入过量SO2气体:ClO-+H2O+SO2═HClO+HSO3- | |
| C. | 向偏铝酸钠溶液中加入碳酸氢钠:AlO2-+3HCO3-═Al(OH)3↓+3CO2↑ | |
| D. | 向NH4HCO3溶液中加入过量NaOH溶液:NH4++HCO3-+2OH-═NH3•H2O+H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
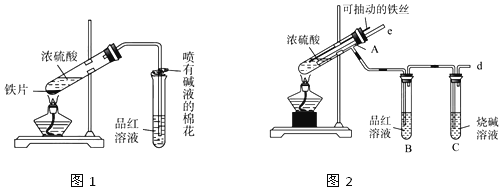
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com