
| A. | ②③⑤ | B. | ①③④ | C. | ②③④ | D. | ①③ |
分析 Fe和稀硝酸反应方程式为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,根据方程式计算被还原的硝酸的物质的量分析解答.
解答 解:含n克HNO3的稀溶液恰好与m克Fe完全反应,生成硝酸铁时,发生Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,溶解Fe的质量最小,根据电子转移守恒n(NO)=$\frac{mg}{56g/mol}$×$\frac{3}{5-2}$=$\frac{m}{56}$mol,
根据氮原子守恒可知n(HNO3)=n(NO)+3n[Fe(NO3)3],即$\frac{m}{56}$mol+$\frac{m}{56}$mol×3=$\frac{ng}{63g/mol}$,整理得整理得2n=9m,
生成硝酸亚铁时溶解Fe的质量最大,根据电子转移守恒n(NO)=$\frac{mg}{56g/mol}$×$\frac{2}{5-2}$=$\frac{m}{84}$mol,
根据氮原子守恒可知n(HNO3)=n(NO)+2n[Fe(NO3)2],
则$\frac{m}{84}$mol+2×$\frac{m}{56}$mol=$\frac{ng}{63g/mol}$,整理得n=3m
故m的取值范围为:$\frac{2}{9}$n≤m≤$\frac{1}{3}$n,②③⑤都符合,
故选A.
点评 本题考查了氧化还原反应的配平及计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度较大.注意利用极限法解答该题.


科目:高中化学 来源: 题型:解答题
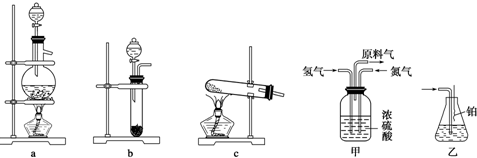
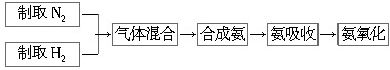
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
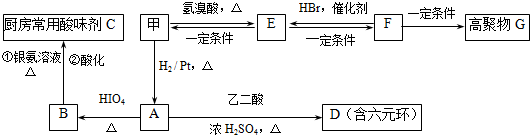
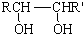 $→_{△}^{HIO_{4}}$ RCHO+R′CHO
$→_{△}^{HIO_{4}}$ RCHO+R′CHO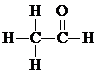 .
.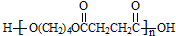 .
.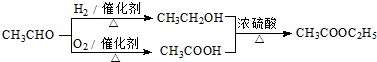
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a<b,则c<$\frac{1}{2}$(a+b) | B. | 若a<b,则c>$\frac{1}{2}$(a+b) | C. | 若a>b,则c=$\frac{1}{2}$(a+b) | D. | 若a=b,则c=$\frac{1}{2}$(a+b) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性A>B>D | |
| B. | B和C形成的化合物中可能有共价键 | |
| C. | 原子序数D>C>A>B | |
| D. | 四种元素中,最高价氧化物对应的水化物酸性最强的是B |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 燃料电池的正极反应式为:O2+2H2O+4e-=4OH- | |
| B. | 装置中NaOH溶液的作用是吸收产生的有毒气体氯气 | |
| C. | 装置中的电子流动路径为:负极→外电路→阴极→苦卤水→阳极→正极 | |
| D. | 理论上,当b 极周围产生2g H2,电池消耗C6H12O6的质量为15g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com