
分析 (1)MnO2与浓盐酸在加热条件下发生氧化还原反应生成氯气;反应中Mn元素化合价由+4价降低到+2价,Cl元素化合价由-1价升高为0价,反应中消耗4mol氯化氢,只有2mol氯化氢中氯元素化合价升高,被氧化,据此计算被氧化的HCl的物质的量;
(2)铝和氢氧化钡溶液反应生成偏铝酸钡和氢气,偏铝酸钡易溶于水易电离;
(3)氢氧化亚铁在氧气和水的作用下生成氢氧化铁,就是氢氧化亚铁与氧气和水发生反应的过程,据此写出化学方程式;
(4)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现软而透明的凝胶胶体硅酸胶体和一种钠盐,该钠盐为碳酸氢钠.
解答 解:(1)MnO2与浓盐酸在加热条件下发生氧化还原反应生成氯气,方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中消耗4mol氯化氢,只有2mol氯化氢中氯元素化合价升高,被氧化,氯元素由-1价升高到0价,所以如有1mol Cl2生成,被氧化的HCl的物质的量是2mol转移电子数为2mol,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;2mol;
(2)铝和氢氧化钡溶液反应生成偏铝酸钡,反应的化学方程式为:2Al+Ba(OH)2+2H2O=Ba(AlO2)2+3H2↑,反应的离子方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
(3)氢氧化亚铁与氧气和水发生反应生成氢氧化铁,反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现软而透明的凝胶胶体硅酸胶体和碳酸氢钠,其离子方程式是:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,
故答案为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
点评 本题考查了方程式的书写方法和注意问题,掌握物质的性质和反应原理是方程式的书写关键,题目难度不大.


科目:高中化学 来源: 题型:填空题

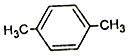 D.
D.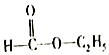
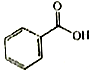 F.
F. 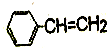 G.
G.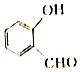
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为河虾中含有砷元素,所以不能食用 | |
| B. | “两者同食”发生的反应中维生素C作氧化剂 | |
| C. | 五价砷在维生素C作用下发生了还原反应 | |
| D. | 已知砒霜的主要成分是氧化砷,可以推测所含的砷元素化合价为+5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)①NH3②SO3③Cl2④BaSO4⑤酒精 ⑥CH3COONH4⑦HClO⑧Cu
(1)①NH3②SO3③Cl2④BaSO4⑤酒精 ⑥CH3COONH4⑦HClO⑧Cu查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol Na与足量O2反应,生成Na2O和Na2O2 的混合物,钠失去电子数为NA | |
| B. | 常温常压下,32gO2 和O3 的混合气体所含原子数为2NA | |
| C. | 22.4LCl2含有的原子数为2NA | |
| D. | 标准状况下,1molFe与22.4LCl2充分反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物都是非金属氧化物 | |
| B. | 乙醇和二甲醚分子式相同,结构不同,互为同素异形体 | |
| C. | 丁达尔效应可用于区别溶液与胶体 | |
| D. | 熔融状态能导电的物质一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体一定是均一、透明、介稳的 | B. | 用丁达尔效应区别胶体和溶液 | ||
| C. | 可以用滤纸来分离胶体和溶液 | D. | 胶体只能在液体中形成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com