
| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻储存 | |
| C. | PM2.5是指大气中直径接近2.5×10-6m的颗粒物,它分散在空气中形成胶体 | |
| D. | 人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 |
分析 A.半导体导电性介于导体与绝缘体之间;
B.高温下蛋白质发生变性;
C.胶体粒子的直径介于1nm~100nm之间;
D.人体不含能使纤维素水解的酶,因此纤维素不能作为人体的营养食物;
解答 解:A.硅导电性介于导体与绝缘体之间为良好的半导体,是制造计算机芯片的材料,二氧化硅为绝缘体,故A错误;
B.高温下蛋白质发生变性,则了防止蛋白质变性,疫苗等生物制剂应冷冻储存,故B错误;
C.胶体粒子的直径介于1nm~100nm之间,PM2.5是指大气中直径≤2.5×10-6m的颗粒物,不一定为胶体,故C错误;
D.人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物,故D正确;
故选:D.
点评 本题考查了硅、二氧化硅的用途区别,蛋白质的盐析与变性,胶体的本质特征,纤维素的性质,题目难度不大,掌握基础是关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:填空题
FeCO3与砂糖混用可作补血剂。以黄铁矿烧渣(含CuO、Fe2O3、FeO、SiO2、Al2O3等)为主要原料制备FeCO3的流程如下:
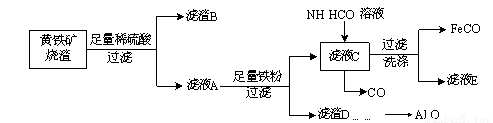
(1)质量分数为30%(密度是1.176 g·cm-3)的稀硫酸的物质的量浓度为 。
(2)检验滤液A中存在Fe2+的试剂是 。
(3)加入足量铁粉的作用除调节pH使Al3+转化为Al(OH)3沉淀外,还有两个作用,写出其中一个反应的离子方程式: 。
(4)写出滤液C与NH4HCO3溶液反应的离子方程式: 。
(5)FeCO3在空气中灼烧可制得铁系氧化物材料。已知25℃,101 kPa时:
4Fe(s)+3O2(g) 2Fe2O3 ΔH=﹣1648 kJ·mol-1
2Fe2O3 ΔH=﹣1648 kJ·mol-1
C(s)+O2(g) CO2(g) ΔH=﹣393 kJ·mol-1
CO2(g) ΔH=﹣393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g) 2FeCO3(s) ΔH=﹣1480 kJ·mol-1
2FeCO3(s) ΔH=﹣1480 kJ·mol-1
写出FeCO3在空气中灼烧生成Fe2O3的热化学方程式: 。
(6)某兴趣小组为充分利用副产品,欲利用滤渣D为原料制取Al2O3,请补充完成实验步骤:向滤渣D中加入适量NaOH溶液, 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为6 | B. | 质子数为8 | C. | 核外电子数为14 | D. | 质量数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
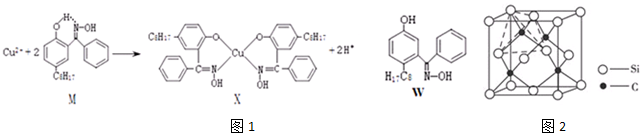
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
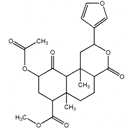
| A. | 分子中含有6个手性碳原子 | |
| B. | 能使酸性高锰酸溶液褪色 | |
| C. | 1mol该有机物最多可与含3molNaOH的水溶液反应 | |
| D. | 1mol该有机物最多可与3molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性由强到弱的顺序:Z、W、X | |
| B. | 原子半径由大到小的顺序:W、Z、Y、X | |
| C. | 原子最外层电子数由多到少的顺序:Y、X、W、Z | |
| D. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y、W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
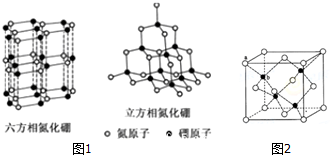
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com