
·ÖĪö £Ø1£©øł¾ŻÅäÖĘ²½ÖčŹĒ¼ĘĖć”¢ĮæČ””¢Ļ”ŹĶ”¢ĄäČ“”¢ŅĘŅŗ”¢Ļ“µÓ”¢¶ØČŻ”¢Ņ”ŌČ”¢×°ĘæĄ“·ÖĪöŠčŅŖµÄŅĒĘ÷£»
£Ø2£©ĻČ¼ĘĖć³öÅØĮņĖįµÄĪļÖŹµÄĮæÅضČĪŖc=$\frac{n}{V}$£¬Č»ŗóøł¾ŻČÜŅŗĻ”ŹĶ¶ØĀÉCÅØVÅØ=CĻ”VĻ”Ą“¼ĘĖć£»
½ā“š ½ā£ŗ£Ø1£©98%µÄÅØĮņĖį£ØĘäĆܶČĪŖ1.84g/cm3£©µÄĪļÖŹµÄĮæÅضČĪŖc=$\frac{1000¦Ń¦Ų%}{M}$=$\frac{1000”Į1.84”Į98%}{98}$=18.4mol/L£¬ÉčÅäÖĘČÜŅŗĖłŠčµÄÅØĮņĖįµÄĢå»żĪŖVmL£¬ŌņÓŠ£ŗ18.4mol/L”ĮVmL=1mol/L”Į500mL£¬½āµĆV=27.2mL£¬¹ŹÓ¦Ń”Ōń50mLĮæĶ²£¬¹Źøł¾ŻÅäÖĘ²½ÖčŹĒ¼ĘĖć”¢ĮæČ””¢Ļ”ŹĶ”¢ĄäČ“”¢ŅĘŅŗ”¢Ļ“µÓ”¢¶ØČŻ”¢Ņ”ŌČ”¢×°ĘææÉÖŖĖłŠčµÄŅĒĘ÷ĪŖ²£Į§°ō”¢½ŗĶ·µĪ¹Ü”¢50mLĮæĶ²”¢ÉÕ±”¢500mLČŻĮæĘ棬¹Ź“š°øĪŖ£ŗ500mLČŻĮæĘ棻
£Ø2£©¢Ł¶ØČŻŹ±ø©ŹÓæĢ¶ČĻß¹Ū²ģŅŗĆę£¬ŌņČÜŅŗĢå»żĘ«Š”£¬ŌņÅضČĘ«øߣ¬¹Ź¢ŁÕżČ·£»
¢ŚČŻĮæĘæŹ¹ÓĆŹ±Ī“øÉŌļ£¬¶ŌČÜŅŗÅضČĪŽÓ°Ļģ£¬¹Ź¢Ś“ķĪó£»
¢Ū¶ØČŻŗó¾Õńµ“”¢Ņ”ŌČ”¢¾²ÖĆ£¬·¢ĻÖŅŗĆęµĶÓŚæĢ¶ČĻߏĒÕż³£µÄ£¬ŌŁ¼ÓÕōĮóĖ®²¹ÖĮæĢ¶ČĻߣ¬ŌņÅضČĘ«µĶ£¬¹Ź¢Ū“ķĪó£»
¢ÜĮæČ”ÅØĮņĖįŹ±ŃöŹÓĮæĶ²æĢ¶Č£¬ŌņĖłĮæČ”µÄÅØĮņĖįµÄĢå»żĘ«“ó£¬ÅäÖĘ³öČÜŅŗµÄÅضČĘ«øߣ¬¹Ź¢ÜÕżČ·£»
¢ŻŅĘŅŗŹ±Ī“Ļ“µÓÉÕ±ŗĶ²£Į§°ō£¬»įµ¼ÖĀČÜÖŹµÄĖšŹ§£¬ŌņÅضČĘ«µĶ£¬¹Ź¢Ż“ķĪó£®
¢ŽČŻĮæĘæĪ“Ļ“¾»£¬ŌĄ“Ź¢¹żøĆČÜŅŗ£¬»įµ¼ÖĀČÜÖŹµÄĮæĘ«¶ą£¬ŌņÅضČĘ«øߣ¬¹Ź¢ŽÕżČ·£»
¢ßĪ“ĄäČ“µ½ŹŅĪĀ¾Ķ¶ØČŻ£¬ŌņĄäČ“ŗóČÜŅŗĢå»żĘ«Š”£¬ÅضČĘ«øߣ¬¹Ź¢ßÕżČ·£®
¹ŹŃ”¢Ł¢Ü¢Ž¢ß£®
µćĘĄ ±¾Ģāæ¼²éĮĖŅ»¶ØĪļÖŹµÄĮæÅضČČÜŅŗµÄÅäÖĘ¹ż³ĢÖŠµÄ¼ĘĖćŗĶĪó²ī·ÖĪö£¬ŹōÓŚ»ł“”ŠĶĢāÄ棬ÄŃ¶Č²»“ó£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
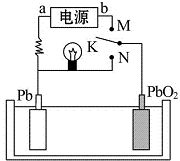
| A£® | KÓėNĻą½ÓŹ±£¬Pbµē¼«µÄ·“Ó¦Ź½ĪŖPb-2e-”śPb2+ | |
| B£® | KÓėNĻą½ÓŹ±£¬SO42-ĻņPbO2µē¼«ĒØŅĘ | |
| C£® | KÓėMĮ¬½ÓŹ±£¬ĖłÓƵēŌ“µÄa¼«ĪŖøŗ¼« | |
| D£® | KÓėMĻą½ÓŹ±£¬Ńō¼«ø½½üµÄpHÖš½„Ōö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NH4+”¢SO42-”¢CO32-”¢K+ | B£® | Na+”¢Ba2+”¢Ca2+”¢HCO3- | ||
| C£® | Mg2+”¢Ag+”¢K+”¢Cl- | D£® | K+”¢Cl-”¢Na+”¢SO42- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
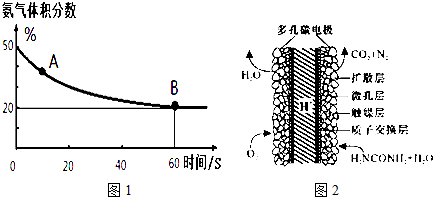
| ĪĀ¶Č£Ø”ę£© | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| Ę½ŗāĘųĢå×ÜÅØ¶Č £Ø10-3mol/L£© | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
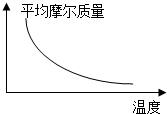 æÉÄę·“Ó¦2A+B?2C£Øg£©£ØÕż·“Ó¦·ÅČČ£©£¬ĖęĪĀ¶Č±ä»ÆĘųĢåĘ½¾łÄ¦¶ūÖŹĮæČēĶ¼ĖłŹ¾£¬ŌņĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©
æÉÄę·“Ó¦2A+B?2C£Øg£©£ØÕż·“Ó¦·ÅČČ£©£¬ĖęĪĀ¶Č±ä»ÆĘųĢåĘ½¾łÄ¦¶ūÖŹĮæČēĶ¼ĖłŹ¾£¬ŌņĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©| A£® | AŗĶBæÉÄܶ¼ŹĒ¹ĢĢå | B£® | AŗĶBŅ»¶Ø¶¼ŹĒĘųĢå | ||
| C£® | ČōBĪŖ¹ĢĢ壬ŌņAŅ»¶ØŹĒĘųĢå | D£® | AŗĶB²»æÉÄܶ¼ŹĒĘųĢå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

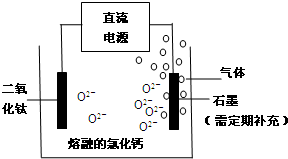
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com