
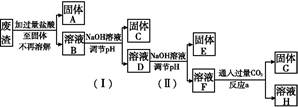
 Al(OH)3↓+NaHCO3
Al(OH)3↓+NaHCO3 Al
Al +2H2O、Mg2++2OH-
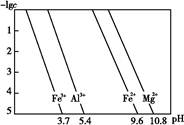
+2H2O、Mg2++2OH- Mg(OH)2↓ ③10-11.4
Mg(OH)2↓ ③10-11.4 。当pH=10.8时镁离子完全沉淀,此时可以看做Mg2+浓度为10-5 mol/L,溶液中OH-浓度为10-3.2 mol/L,则有Ksp=c(Mg2+)·c2(OH-)=10-5×(10-3.2)2=10-11.4。
。当pH=10.8时镁离子完全沉淀,此时可以看做Mg2+浓度为10-5 mol/L,溶液中OH-浓度为10-3.2 mol/L,则有Ksp=c(Mg2+)·c2(OH-)=10-5×(10-3.2)2=10-11.4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
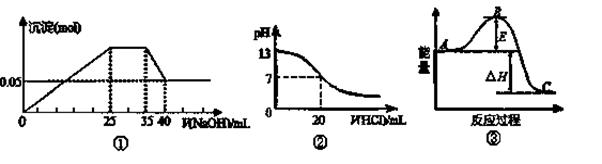
| A.图②表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH 随加入酸体积的变化 |
| B.图①中使用的NaOH的浓度一定为2 mol/L |
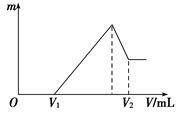
| C.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+)∶n(Al3+):n( NH4+)=2∶3∶2 |
D.图③中曲线表示3H2(g)+N2(g) 2NH3(g)反应过程能量变化,若使用催化剂,B点会升高 2NH3(g)反应过程能量变化,若使用催化剂,B点会升高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4AlCl3(g)+3O2(g) ΔH>0 。下列分析错误的是( )
4AlCl3(g)+3O2(g) ΔH>0 。下列分析错误的是( )| A.增大反应体系的压强,反应速率可能加快 |
| B.加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量 |
| C.电解熔融的Al2O3和AlCl3溶液均能得到单质铝 |
| D.将AlCl3·6H2O在氯化氢气流中加热,也可制得无水氯化铝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
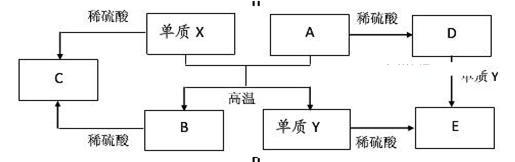
 Fe2O3 + 2Al
Fe2O3 + 2Al 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xFe2O3的铝灰制备Al2(S04)3
xFe2O3的铝灰制备Al2(S04)3 18H2O,工艺流程如下:
18H2O,工艺流程如下: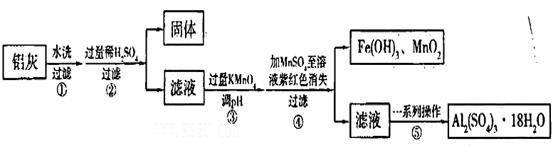
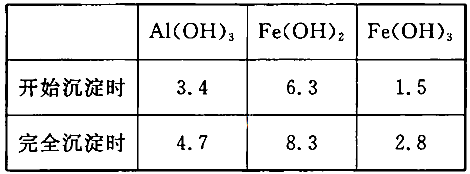
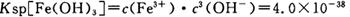 当pH=2时,Fe3+开始沉淀的浓度为_______________。
当pH=2时,Fe3+开始沉淀的浓度为_______________。| A.蒸发皿 | B.坩埚 | C.玻璃棒 | D.酒精灯E.漏斗 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.6:1 | B.3:1 | C.2:1 | D.1:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 样品甲 | 生成白色沉淀,继续滴加氢氧化钠溶液,沉淀消失 |
| 样品乙 | 生成白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com