
【化学——选修3:物质结构与性质】
(1)元素的第一电离能:Al________Si(填“>”或“<”)。
(2)基态Mn2+的核外电子排布式为____________。
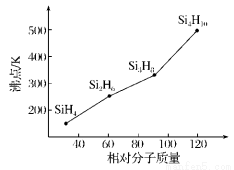
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是________________________。
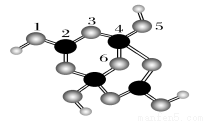
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
①在Xm-中,硼原子轨道的杂化类型有________;配位键存在于________原子之间(填原子的数字标号);m=________(填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有________ (填序号)。
A离子键 B共价键 C金属键 D范德华力 E氢键
科目:高中化学 来源:2016-2017学年湖南浏阳一中等两校高二12月联考化学卷(解析版) 题型:选择题
升高温度能加快化学反应速率的主要原因是( )
A.增加活化分子百分数 B.降低活化分子的能量
C.活化分子能量明显增加 D.降低反应所需的能量
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上月考五化学试卷(解析版) 题型:选择题
工业上曾经通过反应“3Fe+4NaOH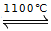 Fe3O4+2H2↑+4Na↑”生产金属钠,己知铁的熔点1535℃、沸点3000℃。下列有关说法正确的是( )
Fe3O4+2H2↑+4Na↑”生产金属钠,己知铁的熔点1535℃、沸点3000℃。下列有关说法正确的是( )
A.增大铁的量可以使反应速率加快
B.每生成1mol H2 ,转移的电子数约为4NA
C.该反应条件下铁的金属性比钠强
D.将生成的气体在空气中冷却可获得钠
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上联考四化学试卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质]X、Y、Z、W是前四周期中常见的四种元素。X的基态原子核外电子共占据5个原子轨道,其中能量最高的能级上的电子有3种运动状态;Y能形成最强的无机含氧酸,Z的单质是前36号元素中最活泼的金属单质,W的一种核素的质量数是56,中子数是30。
(1)W的稳定价态离子的核外电子排布式为_________,Y、Z、W电负性由大到小的顺序为___________(填元素符号)。
(2)X与同周期相邻的另外两种元素相比其第一电离能最大,原因是_____________________X和与X同族的另外两种前四周期元素的简单氢化物的沸点由低到高的顺序为_______________,试解释其原因__________________
(3)XY3的中心原子轨道杂化类型为_________
(4)已知WY3的沸点为319 ℃,熔点为306 ℃,则WY3的晶体类型为____________Z的重要化合物Z2O2中存在的化学键类型有_______________
A.离子键 B.极性共价键 C.非极性共价键 D.π 键
(5)若Z的晶胞为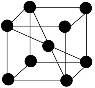 ,Z离子的半径为d cm,则Z单质的密度为_______。
,Z离子的半径为d cm,则Z单质的密度为_______。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上联考四化学试卷(解析版) 题型:选择题
下列各组离子在强酸性溶液中能大量共存,且溶液为无色透明的一组是
A.NH4+、Ca2+、Al3+、Cl- B.Na+、CO32 -、K+、NO3-
-、K+、NO3-
C.MnO4-、K+、SO42-、SO32- D.K+、SO42-、Cl-、Ba2+
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三模拟四化学卷(解析版) 题型:选择题
下列说法不正确的是:
A.麦芽糖及其水解产物均能发生银镜反应
B.饱和硫酸铵和醋酸铅溶液均能使鸡蛋清溶液发生变性
C.浓硫酸具有吸水性,可用于干燥CO2
D.氧化铝具有高熔点,可用作 耐火材料
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:填空题
按要求回答下列问题:
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因 。
(2)用离子方程式表示出泡沫灭火器的原理 。
(3)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中离子浓度由大到小的顺序为 。
(4)常温下,浓度均为0.1mol/L的下列五种溶液的PH值如下表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mol· L-1的下列四种酸的溶液分别稀释100倍,pH变化最小的是 。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是 。
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.NaHCO3+HCN═NaCN+H2O+CO2
(5)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
若向该溶液中滴加NaOH溶液,则先沉淀的是 (填离子符号),
判断Ksp[Fe(OH)2] Ksp[Mg(OH)2](填“>”、“=”或“<”)。
已知Ksp[Cu(OH)2]=2.5×10-20,若向该溶液中加入生石灰调节其pH,当pH= 时,溶液中Cu2+沉淀完全。[已知1g2=0.3]
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:选择题
在常温下,下列各组溶液的c(H+)一定等于1×10-7mol/L的是(溶液混合时忽略体积的变化)( )
A.将pH=5的CH3COOH溶液稀释100倍
B.0.10mol/L H2SO4与0.10mol/L NaOH溶液等体积混合
C.pH=2和pH=12的两种溶液等体积混合
D.pH=1的H2SO4与0.05mol/L 的Ba(OH)2溶液等体积混
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考二化学卷(解析版) 题型:选择题
下列有关反应或对事实解释的离子方程式不正确的是
A.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-=SiO32-+H2O
B.双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.消毒液与洁厕灵(主要成分是HCl)混用,产生有毒Cl2:2H++Cl-+ClO-=Cl2+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com