
【题目】已知空气组成(体积分数)N2:0.800,O2:0.200,氨空气氧化后的混合气体组成如下(高温下NO与O2可以共存)NO:16 mol;O2:7.00 mol;H2O:24.5 mol;N2:112 mol。
完成下列计算:
(1)该混合气体中NO全部转化为HNO3,需要___________摩尔O2 。
(2)参加反应的空气的体积是___________升。(标准状况下)
(3)向该混合气体中添加空气使NO完全转化为 HNO3,转化后剩余气体中(不含H2O)氧气体积分数为0.0500。添加空气多少摩尔?___________
(4)该混合气体的组成表明NH3氧化产生的NO超过16 mol,有部分NO已和O2、H2O 反应转化为HNO3。这部分NO是多少摩尔? _______
【答案】12 2352 69 0.500
【解析】
(1)NO完全转化为硝酸,发生反应:4NO+3O2+2H2O=4HNO3,据此计算需要氧气总物质的量,减去混合气体中氧气物质的量即为需要加入的氧气;
(2)氮气不参加反应,结合氮气体积分数计算通入空气体积,用通入的空气体积减去剩余空气的体积即为参加反应的空气体积;
(3)剩余气体为氮气、氧气混合气体,假设需要通入空气为x mol,表示转化后氮气物质的量,根据方程式计算参加反应氧气物质的量,进而表示出剩余氧气物质的量,利用体积分数列方程计算;
(4)反应过程中氮气的量不变,结合氮气体积分数计算原空气中氧气物质的量,根据4NH3+5O2![]() 4NO+6H2O计算参加反应的氧气,根据氧气物质的量守恒计算反应4NO+3O2+2H2O=4HNO3中消耗的氧气,进而计算转化为HNO3的NO。
4NO+6H2O计算参加反应的氧气,根据氧气物质的量守恒计算反应4NO+3O2+2H2O=4HNO3中消耗的氧气,进而计算转化为HNO3的NO。
(1)NO完全转化为硝酸,发生反应:4NO+3O2+2H2O=4HNO3,根据方程式可知n(NO):n(O2)=4:3,n(NO)=16 mol,所以反应需要氧气总物质的量n(O2)=16 mol×![]() =12 mol;
=12 mol;
(2)氮气不参加反应,N2的体积分数为0.800,故通入空气体积为V(空气)=![]() ×22.4 L/mol=3136 L,则参加反应的空气体积为:3136L-
×22.4 L/mol=3136 L,则参加反应的空气体积为:3136L-![]() ×22.4 L/mol=2352L;
×22.4 L/mol=2352L;
(3)剩余气体为氮气、氧气混合气体,假设需要通入空气的物质的量为x mol,表示转化后N2物质的量为112 mol+0.8x mol,4NO+3O2+2H2O=4HNO3,需要氧气总物质的量为n(O2)=16 mol×![]() =12 mol,则剩余氧气为0.2x mol+7.00 mol-12 mol=(0.2x-5)mol,转化后剩余气体中(不含H2O) O2体积分数为0.0500。则
=12 mol,则剩余氧气为0.2x mol+7.00 mol-12 mol=(0.2x-5)mol,转化后剩余气体中(不含H2O) O2体积分数为0.0500。则![]() =0.0500,解得x=69 mol;
=0.0500,解得x=69 mol;
(4)空气中N2与O2的物质的量比4:1,反应过程中N2的量不变,原来O2的物质的量为112 mol×![]() =28 mol。
=28 mol。
设转化为HNO3的物质的量为n mol,则氨氧化产生的NO的物质的量为(16+n)mol,
由4NH3+5O2![]() 4NO+6H2O可知,生成(16+n)mol NO消耗氧气为(16+n)mol×
4NO+6H2O可知,生成(16+n)mol NO消耗氧气为(16+n)mol×![]() =(20+
=(20+![]() n)mol,则4NO+3O2+2H2O=4HNO3中消耗O2的物质的量为:28 mol-7 mol-(20+
n)mol,则4NO+3O2+2H2O=4HNO3中消耗O2的物质的量为:28 mol-7 mol-(20+![]() n)mol=
n)mol=![]() n mol,解得n=0.500。
n mol,解得n=0.500。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(Fe3+)=0.1 mol·L-1的溶液中:Na+、Cu2+、Cl-、SCN-
B.使甲基橙变红色的溶液中:K+、Fe2+、Cl-、MnO4-
C.由水电离出的c(H+)=10-12mol·L-1的溶液:Na+、K+、CO32-、SO42-
D.![]() =10-12的溶液中:Mg2+、Al3+、NO3-、SO42-
=10-12的溶液中:Mg2+、Al3+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以干海带为原料提取碘单质和氯化钾的过程主要分三步:完成下列填空:
(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质。实验室灼烧海带应放在_____________(填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是____。
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液。实验室模拟氧化过程的实验装置如图所示。
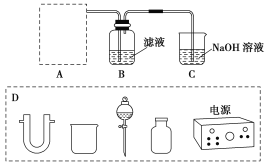
装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl-;二是电解法。限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是________(选填编号)。
a.2NaCl(s)+MnO2+2H2SO4(浓)加热MnSO4+Cl2↑+Na2SO4+2H2O
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O通电2NaOH+Cl2↑+H2↑
d.4HCl(浓)+MnO2加热MnCl2+Cl2↑+2H2O
广口瓶B中发生反应的离子方程式是____________。装置C中NaOH的作用是_______________。
(3)步骤三:取100 mL B中富碘溶液,按如下流程分离碘单质。
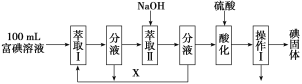
萃取Ⅱ和酸化过程发生的反应分别是:
3I2+6OH-→5I-+IO3-+3H2O;
5I-+IO3-+6H+→3I2+3H2O;
萃取剂X应选择________(选填编号)。
a.100 mL苯 b.10 mL乙醇 c.10 mL CCl4 d.10 mL己烯
实验室进行萃取操作的仪器是________。操作Ⅰ的名称是________。
(4)分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:①要用到的化学试剂是_________(填写化学式);②要测定的物理量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() Z(g)+W(s);△H >0
Z(g)+W(s);△H >0
下列叙述正确的是
A. 减少少量W,逆反应速率减小
B. 当容器中气体的平均摩尔质量不变时,反应达到平衡
C. 降低温度,平衡正向移动
D. 平衡后加入Z,上述反应的△H减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温、催化剂条件下,某反应达到平衡,平衡常数K=![]() 恒容时,温度升高,H2浓度减小.下列说法正确的是( )
恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A. 该反应的焓变为负值
B. 2CO2(g)+2H2(g)2CO(g)+2H2O(g) 的平衡常数K1=K2
C. 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
D. 若恒容、恒温下充入CO,则K值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子式为C2H6O的有机化合物性质相同
B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能途径a:C![]() CO+H2
CO+H2![]() CO2+H2O 途径b:C
CO2+H2O 途径b:C![]() CO2
CO2
C.食物中可加入适量的食品添加剂,如香肠中可以加少量的亚硝酸钠以保持肉质新鲜
D.生石灰、铁粉、硅胶是食品包装中常用的干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出或完成下列热化学方程式。
(1)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧的热化学方程式__________。
(2)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能。
化学键 | C-H | C-F | H-F | F-F |
键能kJ/mol | 414 | 489 | 565 | 155 |
根据键能数据估算下列反应:CH4(g) + 4F2(g)=CF4(g) + 4HF(g)的反应热△H为_____。
(3)1840年瑞士的化学家盖斯(Hess)在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
请写出CO还原FeO的热化学方程式:______。
(4)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为__________;
②氢气燃烧热的热化学方程式为________;
(5)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1。
则ΔH2=_______kJ·mol-1;
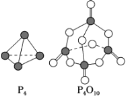
(6)白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH为_____。
(7)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(红磷,s)+5/4O2(g)=1/4P4O10(s) ΔH2=-738.5 kJ·mol-1
相同状况下,能量较低的是________;白磷的稳定性比红磷________(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常数可用NA表示,下列叙述中正确的是( )
A.1mol H2O所含的原子数为NA个
B.16g O2-含有的电子数为10NA个
C.常温常压下,11.2L Cl2所含分子数为0.5NA个
D.1L 1mol/L NaClO溶液中含ClO-个数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2SO3水溶液中存在电离平衡H2SO3![]() H++ HSO3- 和HSO3-
H++ HSO3- 和HSO3-![]() H++ SO32-,若对H2SO3溶液进行如下操作,则结论正确的是:( )
H++ SO32-,若对H2SO3溶液进行如下操作,则结论正确的是:( )
A.通入氯气,溶液中氢离子浓度增大
B.通入过量H2S,反应后溶液pH减小
C.加入氢氧化钠溶液,平衡向右移动,pH变小
D.加入氯化钡溶液,平衡向右移动,会产生亚硫酸钡沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com