
| A. | 向平衡体系中加入少量KCl固体或Fe(SCN)3固体,溶液红色都变浅 | |
| B. | 向平衡体系中加入少量FeCl3固体或KSCN固体,溶液红色加深 | |
| C. | 向平衡体系中加入水稀释,平衡不移动,但溶液红色变浅 | |
| D. | 该反应的离子方程式为:3KSCN+Fe3+═Fe(SCN)3(血红色)+3K+ |
分析 A、根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变;
B、加入少量氯化铁固体或KSCN固体,平衡正向进行;
C、加水促进弱电解质的电离;
D、根据实际参加反应的离子书写离子方程式.
解答 解:A、根据实际参加反应的离子浓度分析,化学平衡为Fe3++3SCN-=Fe(SCN)3,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,溶液颜色不变,故A错误;
B、加入少量氯化铁固体或KSCN固体,溶液中Fe3+或SCN-浓度增大,平衡正向进行,溶液颜色加深,故B正确;
C、Fe(SCN)3属于盐类,是血红色溶液中的溶质成分,加水促进弱电解质的电离,平衡逆向移动,故C错误;
D、该反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,故D错误;
故选B.
点评 本题考查化学平衡的影响因素分析判断,注意建立平衡的微粒分析应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中K+、Fe2+、SCN-、Br-可以大量存在 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 和Ba(OH)2溶液反应离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 1L0.1 mol•L-1该溶液和足量的Zn充分反应,生成11.2gFe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.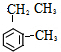 .
. (假设按1:1:1的单体比例合成).
(假设按1:1:1的单体比例合成). ,制取写出相关的化学方程式:
,制取写出相关的化学方程式: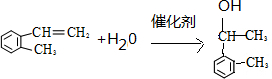 、
、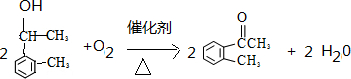 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35% | B. | 70% | C. | 17.5% | D. | 0.035% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
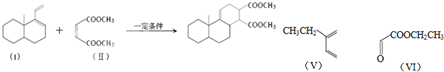
 .
. .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示.装置如图2所示
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示.装置如图2所示 +H2O→
+H2O→ +M(OH)Br(碱式溴化镁)
+M(OH)Br(碱式溴化镁)| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸已酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,溶于乙醇、醚等多数有机溶剂 | |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com