
【题目】由化合物A合成黄樟油(E)和香料F的路线如下(部分反应条件己略去):
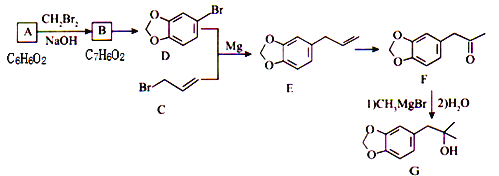
请回答下列问题:
(1)下列有关说法正确的是______________(填选项字母)。
a 化合物A核磁共振氢谱为两组峰
b CH2Br2只有一种结构
c 化合物E能发生加聚反应得到线型高分子
d 化合物B能发生银镜反应,也能与NaOH溶液反应
(2)由B转化为D所需的试剂为________________。
(3) D含有的官能团名称为________________。
(4)写出A→B的化学反应方程式:_______________。
(5)满足下列条件的E的同分异构体W有__________种(不含立体异构),其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为_________。
①1molW与足量NaOH溶液反应,能消耗2molNaOH
②能发生银镜反应
③苯环上只有两个取代基,能发生聚合反应
【答案】bc 液溴、Fe (或液溴、FeBr3) 醚键、溴原子、1-溴丙烯 ![]() 9
9 ![]()
【解析】
根据A、B的分子式、D的结构简式,可知A为![]() ,B为
,B为![]() ,结合物质的结构简式、转化关系图以及问题分析解答。
,结合物质的结构简式、转化关系图以及问题分析解答。
(1)A为![]() ,B为
,B为![]() 。
。
a.化合物A 有3种化学环境不同的H原子,核磁共振氢谱为3组峰,故a错误;
b.CH2Br2是空间四面体结构,CH2Br2只有一种结构,故b正确;
c.化合物E含有碳碳双键,能发生加聚反应得到线型高分子,故c正确;
d.化合物B没有醛基,不能发生银镜反应,故d错误。
故选bc;
(2)对比B、D结构,由B转化为D发生苯环的溴代反应,所需试剂为:液溴、Fe(或液溴、FeBr3),故答案为:液溴、Fe(或液溴、FeBr3);
(3)D中含有-Br、![]() ,官能团名称为溴原子、醚键,C的同分异构体中具有顺反异构,该同分异构体为CH3CH=CHBr,该同分异构体名称为:1-溴丙烯,故答案为:溴原子、醚键;1-溴丙烯;
,官能团名称为溴原子、醚键,C的同分异构体中具有顺反异构,该同分异构体为CH3CH=CHBr,该同分异构体名称为:1-溴丙烯,故答案为:溴原子、醚键;1-溴丙烯;
(4)A→B是![]() 与CH2Br2发生取代反应生成
与CH2Br2发生取代反应生成![]() ,同时还生成的HBr会与氢氧化钠发生中和反应,反应方程式为:
,同时还生成的HBr会与氢氧化钠发生中和反应,反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(5)①lmolW与足量NaOH溶液反应,能消耗2molNaOH,说明含有羧酸与酚形成的酯基;②能发生银镜反应,应是甲酸与酚形成的酯,③能发生聚合反应,还含有碳碳双键,且苯环上只有两个取代基,其中一个为-OOCH,另外一个为-CH2CH=CH2、或者-CH=CHCH2、或者-CH(CH3)=CH2,2个取代基有邻、间、对3种,故符合条件的共有9种,其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为:![]() ,故答案为:9;
,故答案为:9;![]() 。
。


科目:高中化学 来源: 题型:
【题目】化合物F是一种重要的有机合成中间体,它的合成路线如下:

(1)化合物F中含氧官能团的名称是_________和_________。
(2)由B生成C的化学反应类型是________。
(3)写出化合物B的结构简式:__________。
(4)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢。写出该化合物的结构简式:__________(任写一种)。
(5)请根据已有知识并结合相关信息,写出以苯酚(![]() )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物![]() 的合成路线流程图_____________________________(无机试剂任用)。
的合成路线流程图_____________________________(无机试剂任用)。
合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 对于A(s)+B(g) ![]() C(g)+D(g)的反应,加入A,反应速率加快
C(g)+D(g)的反应,加入A,反应速率加快
B. 2NO2![]() N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
C. 一定温度下,反应 N2(g)+3H2(g) ![]() 2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
D. 100 mL2 mol·L—1稀盐酸与锌反应时,加入少量硫酸铜固体,生成氢气的速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
(资料)
该“碘钟实验”的总反应:H2O2 +2S2O32-+2H+=S4O62-+2H2O
反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是______。对于总反应,I-的作用相当于______。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是______。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液 (含淀粉) | H2O |
实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
实验Ⅲ | 5 | 2 | x | y | z |
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30 min、实验Ⅲ是40 min。
①实验Ⅲ中,x、y、z所对应的数值分别是______。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是______。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。
(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液(含淀粉) | H2O |
实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4L密闭容器中充入6molA气体和5molB气体,一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol/L,下列判断正确的是( )
2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol/L,下列判断正确的是( )
A.B的转化率为20%B.平衡时A的浓度为1.50mol/L
C.x=1D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-QkJ·mol-1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH=-QkJ·mol-1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
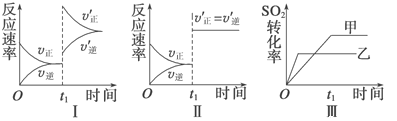
A. 图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响
C. 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某反应达到平衡,其平衡常数为![]() 。恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
。恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
A. 该反应的化学方程式为:NO2+CO = CO2+NOB. 该反应的焓变为负值
C. 升高温度,正反应速率减小D. 恒温时,增大压强,颜色加深,因平衡左移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是( )
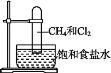
A.此反应无光照也可发生
B.甲烷和Cl2反应后的产物只有CH3Cl和HCl
C.CH4和Cl2完全反应后液面上升,液体充满试管
D.盛放饱和食盐水的水槽底部会有少量晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A. 500mL2mol·L-1 FeCl3溶液中Cl-数目为3NA,且n(Cl-)/n(Fe3+)=3
B. 电解法精炼铜,阴极析出1 mol Cu时,阳极失去的电子数为2NA
C. 64gSO2与足量的O2在一定条件下反应生成的SO3分子数目为NA
D. 在标准状况下,2.24LNH3通入水中制成氨水,溶液中NH4+数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com