
| A、分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28g |
| B、常温下,1L0.1mol.L-1的NH4NO3溶液中NH4+和NO3-总数为0.2NA |
| C、标准状况下,4.48 L重水(D20)含有的中子数为2NA |
| D、1 mol甲基(-CH3)所含电子数为9NA |


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、0.3mol |
| B、0.15mol |
| C、小于0.15mol |
| D、大于0.15mol,小于0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
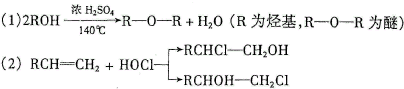

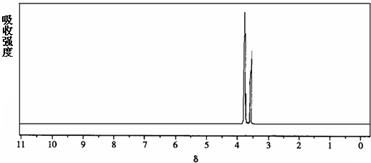
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
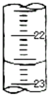 实验室用中和滴定法测定待测烧碱溶液的浓度,试根据实验回答:
实验室用中和滴定法测定待测烧碱溶液的浓度,试根据实验回答:| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:
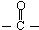 )的化合物反应生成醇,其过程可表示如下:
)的化合物反应生成醇,其过程可表示如下: (-R1、-R2表示烃基)
(-R1、-R2表示烃基)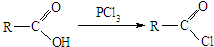
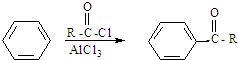
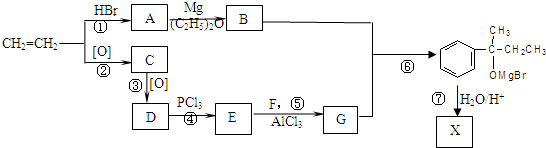
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、部分卤代烃可用作灭火剂 |
| B、石油分馏是物理变化,可得到的产品有汽油、煤油和柴油 |
| C、提倡人们购物时不用塑料袋,是为了防止白色污染 |
| D、35%-40%甲醛溶液俗称为福尔马林,可用来浸泡海产品来起到保鲜效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验设计或操作 | 观察或记录 | 结论或解释 |
| A | 将少量浓硝酸分多次加入Cu和稀硫酸的混合液中 | 产生红棕色气体 | 硝酸的还原产物是NO2 |
| B | 某粉末用酒精润湿后,用铂丝蘸取做焰色反应 | 火焰呈黄色 | 该粉末一定不含钾盐 |
| C | 在A1C13 和MgCl2 的混合液中加入过量NaOH溶液 | 先生成白色沉淀,后沉淀部分溶解 | 金属性Na>Mg>Al |
| D | 将盛水的分液漏斗先静置,再倒置 | 漏斗口和活塞不渗水 | 分液漏斗不漏液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com