
| A. | CO32-+H2O HCO3-+OH-; 用热的纯碱溶液清洗油污 | |
| B. | SnCl2+H2OSn( OH)Cl+HCl;配制氯化亚锡溶液时加入氢氧化钠溶液 | |
| C. | A13++3HCO3-=Al (OH)3↓+3CO2↑;泡沫灭火器灭火 | |
| D. | A13++3H2OAl (OH)3(胶体)+3H+;明矾净水 |
分析 A.纯碱水解显碱性,可促进油污的水解;
B.氢氧化钠会促进SnCl2水解;
C.A13+与HCO3-发生相互促进的水解反应生成二氧化碳气体,能灭火;
D.铝离子水解生成的氢氧化铝胶体能吸附水中的悬浮颗粒.
解答 解:A.纯碱水解显碱性,即CO32-+H2O?HCO3-+OH-,可促进油污的水解,加热碳酸钠溶液的碱性增强,故A正确;
B.SnCl2在溶液中水解显酸性,加氢氧化钠会促进SnCl2水解,所以配制氯化亚锡溶液时加入HCl抑制水解,故B错误;
C.A13+与HCO3-发生相互促进的水解反应生成二氧化碳气体,即A13++3HCO3-=Al (OH)3↓+3CO2↑,反应生成大量的二氧化碳能灭火,故C正确;
D.明矾在水中电离出铝离子,铝离子水解生成的氢氧化铝胶体,即A13++3H2O?Al (OH)3(胶体)+3H+,氢氧化铝胶体能吸附水中的悬浮颗粒而净水,故D正确.
故选B.
点评 本题考查了盐类水解及应用、物质的性质与用途等,综合考查元素化合物知识及化学反应原理,侧重分析与应用能力的考查,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
| A. |  2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2二溴乙烷 | ||
| C. |  2-甲基丁烯 2-甲基丁烯 | D. | 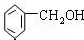 苯甲醇 苯甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O 31P 35Cl | B. | 27Al 19F 12C | ||
| C. | 第一周期所有元素的原子 | D. | 元素周期表中ⅤA所有元素的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
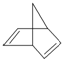 ,其分子式为C7H8.
,其分子式为C7H8. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1(NH4)2SO4溶液中:c(H+)>c(NH4+) | |
| C. | 0.1mol•L-1的HCl溶液与0.1mol•L-1的NaOH溶液等体积混合:c(H+)+c(Na+)═c(OH-)+c(Cl-) | |
| D. | 0.1mol•L-1 CH3COONa溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5 NA | |
| B. | 26g乙炔所含共价键数目为2 NA | |
| C. | 标准状况下,11.2 L CCl4所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
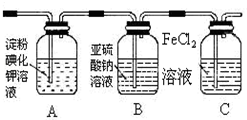
| 实验步骤 | 预期现象和结论 |
步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2mol/LHCl和1mol/LBaCl2溶液 振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42- |
步骤2:另取适量洗气瓶B中溶液于试管B中,滴加滴加入过量lmol/LBa(NO3)2溶液 振荡,静置. | 产生白色沉淀. |
步骤3:取步骤2后试管B中的上层清液于试管C中, 滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡.. | 若产生白色沉淀,则洗气瓶B溶液中存在氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
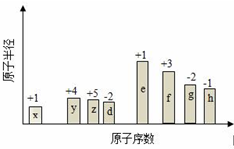 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com