
(15分) (1)某兴趣小组欲准确配制一定物质的量浓度的NaOH溶液:快速准确称取8.0 g 纯净的NaOH固体,配制成100 mL溶液,该NaOH溶液的物质的量浓度为 。所需的仪器除托盘天平、钥匙、小烧杯、玻璃棒外还缺少 。
(2)有机物X由C、H、O三种元素组成的,为确定其结构进行如下实验:
a.6.0 g X在一定条件下完全分解,生成3.36 L(标准状况下)一氧化碳和1.8 g水;
b.中和2.4 g 有机物X需消耗上述NaOH溶液20.00 mL;
c.0.1 mol有机物X完全转化为酯,需要乙醇9.2 g,0.1 mol X能与足量钠反应放出3.36 L(标准状况下)氢气。则:
①X的相对分子质量为 。
②X的分子式为 。
③写出X的结构简式: 。
④写X与足量乙醇发生酯化反应的方程式 。
(1)2.0 mol/L(2分) 100ml容量瓶、胶头滴管(各1分)
(2)①120(3分)②C3H4O5(3分) ③ (3分)
(3分)
④ (2分)
(2分)
解析试题分析:(1)8g氢氧化钠的物质的量=8g÷40g/mol=0.2mol,则物质的量浓度=0.2mol÷0.1L=2.0 mol/L。需的仪器除托盘天平、钥匙、小烧杯、玻璃棒外还缺少100ml容量瓶、胶头滴管等。
(2)生成物CO的物质的量=3.36L÷22.4L/mol=0.15mol,水的物质的量=1.8g÷18g/mol=0.1mol。则根据质量守恒可知6g有机物中氧原子的物质的量是0.15mol+0.1mol=0.25mol,则该有机物中碳氢氧三种原子的个数之比0.15:0.2:0.25=3:4:5。0.1mol物质A完全转化为酯,需要乙醇9.2g÷46g/mol=0.2mol,则A分子中含有2个-COOH;完全中和2.4g物质A,需要消耗0.02L×2.0mol/L=0.04molNaOH,则2.4gA的物质的量为0.02mol,有机物A的摩尔质量为2.4g÷0.02mol=120g/mol,所以共计最简式为C3H4O5可知,该有机物的分子式即为C3H4O5。0.1molA能与足量钠反应放出3.36L(标准状况下)氢气,氢气的物质的量为0.15mol,0.1molA提供0.3molH原子,所以有机物中还含有1个-OH,有机物的分子式为C3H4O5,故有机物A的结构简式为 。才X与足量乙醇发生酯化反应的方程式为
。才X与足量乙醇发生酯化反应的方程式为 。
。
考点:考查一定物质的量浓度配制、有机物分子式、结构简式推断


科目:高中化学 来源: 题型:单选题
下列关于容量瓶及其使用方法的叙述,正确的是( )
①是配制一定物质的量浓度的溶液的专用仪器 ②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热 ④不能用容量瓶贮存配制好的溶液
⑤一定要用500mL容量瓶配制250mL溶液
| A.①③ | B.①②④ | C.①②④⑤ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
CuSO4溶液与K2C2O4溶液反应,得到一种蓝色结晶水合物晶体。通过下述实验确定该晶体的组成:
①称取0.1680g晶体,加入过量的H2SO4溶液,使样品溶解后加入适量水,加热近沸,用0.02000mol·L-1KMnO4溶液滴定至终点(溶液变为浅紫红色),消耗20.00mL。
②接着将溶液充分加热,使浅紫红色变为蓝色,此时MnO—4转化为Mn2+并释放出O2。
③冷却后加入2g KI固体(过量)和适量Na2CO3,溶液变为棕色并生成沉淀。
④用0.05000mol·L-1Na2S2O3溶液滴定,近终点加指示剂,滴定至终点,消耗10.00mL。
已知:2MnO—4+5H2C2O4+6H+==2Mn2++10CO2↑+8H2O
2Cu2++4I—=2CuI↓+I2
2Na2S2O3+I2=2NaI+Na2S4O6
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中加入的指示剂为 。
(3)通过计算写出蓝色晶体的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质。精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用。下图是生产精制硅藻土并获得Al(OH)3的工艺流程。
(1)粗硅藻土高温煅烧的目的是 。
(2)反应Ⅲ中生成Al(OH)3沉淀的化学方程式是 ;氢氧化铝常用作阻燃剂,其原因是 。
(3)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤。
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70 ℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF)。
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol·L-1 NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL。
①步骤1中高温灼烧实验所需的仪器除三角架、泥三角、酒精喷灯外还有 。
a.蒸发皿 b.表面皿 c.瓷坩埚 d.铁坩埚
②实验中使用塑料烧杯和塑料漏斗的原因是 。
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是 。
④步骤4中滴定终点的现象为 。
⑤样品中SiO2的质量分数可用公式“ ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下: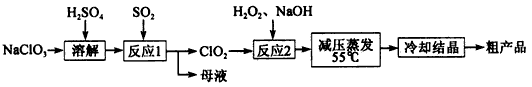
(1)提高“反应l”反应速率的措施有______________(写出一条即可)。
(2)“反应2”的氧化剂是________,该反应的化学方程式为__________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从 “母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经_____________(填操作名称)即可获得粗产品。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下列实验操作都能达到预期目的的是( )
①蒸干AlCl3溶液可得纯净的无水氯化铝;②纸层析法分离铁离子和铜离子实验中,点样后的滤纸需晾干后,才能将滤纸下端浸入展开剂中进行实验;③用广泛pH试纸测得某溶液pH为3.5;④滴入酚酞溶液确定纯碱中有无烧碱;⑤用米汤直接检验食用盐中是否含有碘元素;⑥用酸式滴定管量取20.00 mL高锰酸钾酸性溶液;⑦用溴的四氯化碳溶液除去混在甲烷中的乙烯气体
| A.⑥⑦ | B.②⑥ | C.⑤⑥⑦ | D.只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究小组甲欲用KMnO4测定FeSO4的含量。
(1)①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液200 mL,配制时需要的仪器除天平、药匙外,还需要的仪器有_____、_____、_____、_____、_____。
②用KMnO4(酸化)滴定时,含硫酸亚铁的溶液放在_____(填仪器)中,高锰酸钾溶液放在______(填仪器)中,滴定终点时溶液的颜色为_____色。
(2)另一研究小组乙设计了如下测量方案: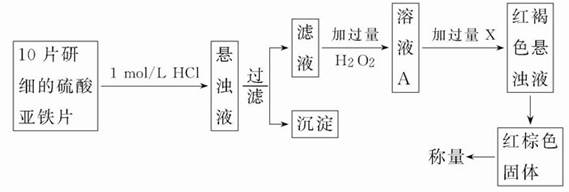
①过滤时用到的玻璃仪器有________________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有_____(按操作的顺序填写)。
A过滤;B洗涤;C萃取;D分液;E冷却;F灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
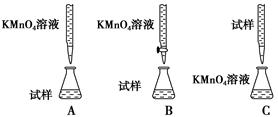
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO4—+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________(填仪器名称)。
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
| A.稀硫酸 | B.浓硝酸 | C.稀硝酸 | D.稀盐酸 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫代硫酸钠(Na2S2O3)可由下面一系列反应制得:
①Na2CO3+SO2 =Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3 + S  Na2S2O3,
Na2S2O3,
常温下溶液中析出晶体为Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;
Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。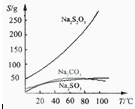
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
请问:仪器2的名称为 ,
装置6中可放入 。
| A.BaCl2溶液 | B.浓H2SO4 |
| C.酸性KMnO4溶液 | D.NaOH溶液 |

 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com