
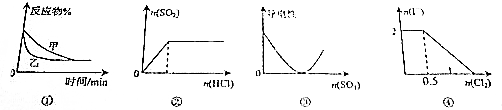
| A. | 图①表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| B. | 图②表示一定浓度的Na2SO3溶液中滴加稀盐酸,生成SO2与HCl的物质的量的关系 | |
| C. | 图③表示在Ba(OH)2溶液中加入SO3至过量的过程中溶液导电性的变化 | |
| D. | 图④表示在1L 1mol•L-1FeI2溶液中,通入Cl2时I-物质的量的变化 |
分析 A.图①应是催化剂对反应速率的影响;
B.一定浓度的Na2SO3溶液中滴加稀盐酸,开始无气体生成,亚硫酸钠和盐酸反应生成亚硫酸氢钠和氯化钠,全部变化为碳酸氢钠后,继续滴加盐酸放出二氧化硫;
C.根据Ba(OH)2溶液和稀硫酸反应生成硫酸钡沉淀以及纯水几乎不导电进行解答;
D.I-还原性大于Fe2+,通入Cl2时先氧化碘离子生成碘单质,碘离子全部被氧化后,继续通入氯气氧化亚铁离子;
解答 解:A.图①中甲乙反应速率不同,但平衡状态相同,由于反应中反应前后气体计量数不同,改变压强平衡发生移动,应为催化剂的影响,故A错误;
B.一定浓度的Na2SO3溶液中滴加稀盐酸,开始无气体生成,亚硫酸钠和盐酸反应生成亚硫酸氢钠和氯化钠,Na2SO3+HCl=NaHSO3+NaCl,全部变化为碳酸氢钠后,继续滴加盐酸放出二氧化硫,NaHSO3+HCl=NaCl+H2O+SO2↑,图象变化不符合,故B错误;
C.加入SO3和水反应生成硫酸,Ba(OH)2溶液和稀硫酸反应生成硫酸钡沉淀,纯水几乎不导电,所以烧杯中溶液导电性逐渐减弱,当恰好反应时导电性0,再继续滴加稀硫酸,溶液中的自由移动的离子增加,导电性逐渐增强,与图象相符,故C正确;
D.I-还原性大于Fe2+,通入Cl2时先氧化碘离子生成碘单质,碘离子全部被氧化后,继续通入氯气氧化亚铁离子,图象不符合,故D错误;
故选C.
点评 本题考查了实验过程和图象变化的分析判断,主要是催化剂作用、盐类水解、酸碱反应后溶液的导电性、氧化还原反应等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.037 | 0.075 | 0.074 | 0.099 |
| A. | Y、Z、W处于周期表中同一周期 | B. | 通常状况下得不到纯净的YZ2 | ||
| C. | X与Z形成的化合物不含非极性键 | D. | X、Z、W形成的化合物为弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HA | H2B | HC | ||
| Ka | K${\;}_{{a}_{1}}$ | K${\;}_{{a}_{2}}$ | K${\;}_{{a}_{3}}$ | K${\;}_{{a}_{4}}$ |
| 数值 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
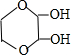 、
、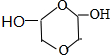 (任写一种)(不考虑立体异构)
(任写一种)(不考虑立体异构)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
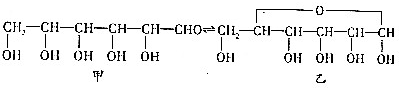
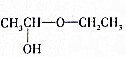 试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→
试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→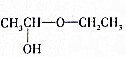 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
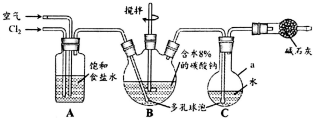 次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.
次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
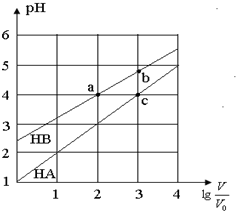 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数a<b | |
| B. | 溶液中水的电离程度:a=c>b | |
| C. | 相同条件下NaA溶液的pH小于NaB溶液的pH | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若同时微热两种溶液(不考虑HA、HB和H2O的挥发),则$\frac{c({B}^{-})}{c({A}^{-})}$减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com