
(14分)工业上生产金属钛的方法很多。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
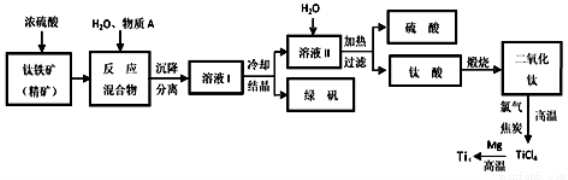
回答下列问题:
(1)钛铁矿和浓硫酸反应属于_________(选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是__________、___________。
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_____________________。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g)
ΔH1 = -72 kJ?mol-1 TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g)
ΔH2 =+38.8kJ?mol-1
C(s)+CO2(g)=2CO(g)? ΔH3 =+282.8kJ?mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行
的原因是______________________。
②反应C(s)+O2(g)=CO2 (g)的ΔH=_______________。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO
作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
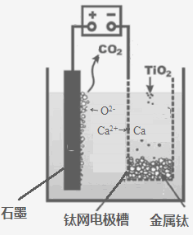
①写出阳极所发生反应的电极反应式:_______________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释) _________。
(1)非氧化还原反应 (1分) (2)Fe 绿矾 、 硫酸 (各1分)
(3)防止高温下Mg(Ti)与空气中的氧气(或CO2、N2)作用)(2分)
(4)① 该反应的△S>0(熵增)(2分) ②-393.6 kJ/mol (2分)
(5)① 2O2- - 4e- == O2↓(同时写出C + O2 == CO2不扣分) 或 C + 2O2- - 4e- == CO2↑ (2分)
②制备TiO2时,在电解槽发生如下反应:2CaO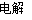 2Ca + O2↑, 2Ca + TiO2一定条件Ti + 2CaO,由此可见,CaO的量不变。(2分
2Ca + O2↑, 2Ca + TiO2一定条件Ti + 2CaO,由此可见,CaO的量不变。(2分
【解析】
试题分析:(1)钛酸亚铁的化学式为FeTiO3,其中铁元素的化合价为+2价,氧元素的化合价为-2价,钛的化合价为+4价,钛铁矿和浓硫酸反应后,TiOSO4中钛的化合价为+4价,硫为+6价,氧元素的化合价为-2价,FeSO4中铁元素的化合价为+2价,氧元素的化合价为-2价,无化合价的变化,是非氧化还原反应;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,所以A是金属铁,根据流程,所得到的副产物是绿矾,可回收利用的物质是硫酸;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和二氧化碳反应生成氧化镁和碳,镁和氮气反应生成氮化镁,所以反应TiCl4+2Mg=2MgCl2+Ti需在Ar气氛中进行;
(4)①根据反应能否自发进行的判据△G=△H-T△S,△H>0,所以高温下才自发进行,说明该反应的△S>0(或熵增加);
②已知反应a、TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ?mol-1、b、TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ?mol-1,c、C(s)+CO2△H?(g)=2CO(g)3=+282.8kJ?mol-1,根据盖斯定律,反应C(s)+O2(g)=CO2(g)可以看成是a-b-c获得,所以该化学反应的焓变△H=-72kJ?mol-1-282.8kJ?mol-1-38.8kJ?mol-1=-393.6 kJ/mol;
(5)①电解池中阳极失去电子,发生氧化反应。根据装置图可知氧离子向阳极移动,则阳极电极反应式为2O2- - 4e- == O2↑。
②根据装置图可知,阴极是钙离子得到电子,发生还原反应,因此制备TiO2时,在电解槽发生如下反应:2CaO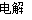 2Ca + O2↑,2Ca + TiO2一定条件Ti + 2CaO,由此可见,CaO的量不变。
2Ca + O2↑,2Ca + TiO2一定条件Ti + 2CaO,由此可见,CaO的量不变。
考点:考查物质制备工艺流程图的有关判断与计算


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是
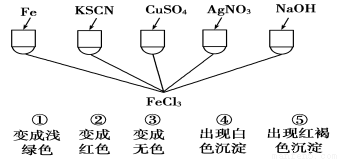
A.只有④ B.只有③ C.③和④均错 D.全部错误
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:填空题
重要的精细化学晶M和N,常用作交联剂、涂料、杀虫剂等,合成路线如下图所示:
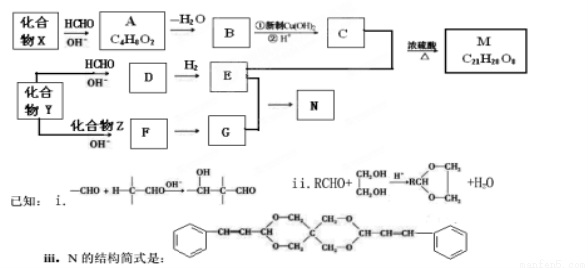
请回答下列问题:
(1)A中氧官能团的名称为__________________.由A生成B的反应类型为________________
(2)X的结构简式为______________________
(3)由B生成C的反应①的化学方程式为______________________
(4)C和甲醇反应的产物可以聚合形成有机玻璃,该聚合反应的化学方程式为___________
(5)E的结构简式为_______________,E的同分异构体有多种,其中与E具有相同官能团的同分异构体有_____________种(提示:同一碳原子上连有两个或以上羟基是不稳定的,)试写出其中一种的结构简式______________.
(6)下列说法正确的是( )
A、E能发生消去反应 B、1mol M中含有4mol 酯基
C、X与Y是同系物 D、1mol G与足量H2加成可消耗2mol H2
(7)由Y生成D的化学方程式为_________________________
(8)Z的结构简式为___________________________.
(9)由F生成G的化学方程式为__________________________.
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
以下说法正确的是()
A.某吸热反应能自发进行,因此该反应是熵增反应
B.常温下Na与足量O2反应生成Na2O随温度升高生成Na2O的速率逐渐加快
C.放热反应速率总是大于吸热反应速率
D.1gH2完全燃烧生成水蒸气时放出热量为121kJ,完全断裂1mol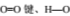 键吸收热量为496kJ、463kJ,则断裂1mol H-H键时吸收热量为902kJ
键吸收热量为496kJ、463kJ,则断裂1mol H-H键时吸收热量为902kJ
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列图示与对应的叙述一定正确的是()
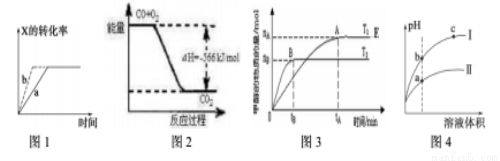
A.图1所示,反应X(g)+2Y(g) 3Z(g),b的压强一定比a大
3Z(g),b的压强一定比a大
B.图2表示CO生成CO2的反应过程和能量关系
C.图3表示反应CO+2H2 CH3OH,其中温度T1>T2,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,平衡正向移动,氢气浓度增大
CH3OH,其中温度T1>T2,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,平衡正向移动,氢气浓度增大
D.图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,II表示醋酸,且溶液导电性c>b>a
查看答案和解析>>
科目:高中化学 来源:2015届四川省2015届高三9月理综化学试卷(解析版) 题型:选择题
有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成: ①CH3COON与HCl②CH3COONa与NaOH ③H3COONa与NaCl ④H3COONa与NaHCO3。下列各项排序正确的是
A.pH: ②>③>④>① B. c(CH3COO-):②>④>③>①
C.溶液中c(H+): ①>③>②>④ D.c(CH3COOH): ①>④>③>②
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三第三次理综考试化学试卷(解析版) 题型:填空题
(12分)人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与酸性KMnO4溶液反应的离子方程式为_______________________________。
(3)滴定时,根据现象_______________________________________,即可确定反应达到终点。
(4)滴定的实验数据如下所示:
实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
查看答案和解析>>
科目:高中化学 来源:2015届四川省资阳市高三一诊理综化学试卷(解析版) 题型:选择题
下列关于阿佛加德罗常数的说法正确的是
A.1 L 0.1 mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1 NA
B.一定条件下的密闭容器中,6.4 g SO2可被氧气氧化得到SO3的分子数为0.1 NA
C.常温下18 g铝放入足量浓硫酸中转移电子数2 NA
D.0.1 NA的NO在一密闭容器中与足量氧气完全反应,得到0.1 mol NO2
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三(补习班)10月月考理综化学试卷(解析版) 题型:选择题
为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是
序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
① | KNO3溶液 | KOH | 滴入稀HNO3,同时用pH试纸测定至溶液呈中性 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | NaNO3 | CaCO3 | 溶解、过滤、蒸发、结晶 |
A.①②③ B.②③④ C.①③④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com