
| A. | “液氯”是纯净物而“氯水”是混合物 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | NO2溶于水发生了氧化反应,它既是氧化剂又是还原剂 | |
| D. | 用玻璃棒分别蘸取浓盐酸和浓氨水并互相靠近,能看到白烟 |
分析 A、液氯是氯气的液态形式,氯水是氯气的水溶液;
B、氢氧化铁胶体为红褐色液体;
C、NO2溶于水反应生成硝酸和NO,反应中只有N元素的化合价变化;
D、根据浓盐酸和浓氨水能反应.
解答 解:A、液氯是氯气的液态形式,氯水是氯气的水溶液,故液氯是纯净物,氯水是混合物,故A正确;
B、氢氧化铁胶体为红褐色液体,透明,能发生丁达尔现象,故B错误;
C、NO2溶于水反应生成硝酸和NO,反应中只有N元素的化合价变化,则NO2既是氧化剂又是还原剂,故C正确;
D、浓盐酸和浓氨水挥发性很强,挥发的出NH3气体和HCl气体可以直接化合,生成氯化铵固体形成白烟,故D正确;
故选B.
点评 本题考查较综合,侧重物质性质的考查,把握氨气、浓盐酸、二氧化氮及钠的性质等为解答的关键,注意发生的反应及现象,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
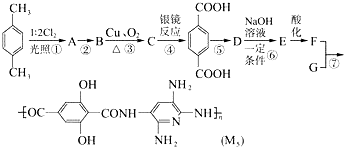
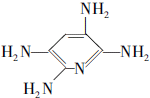 ,F的含氧官能团的名称有羧基、(酚)羟基.
,F的含氧官能团的名称有羧基、(酚)羟基.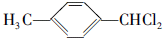 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中有18列,即18个族 | |
| B. | 目前使用的元素周期表中,最长的周期含有32种元素 | |
| C. | 短周期元素是指1~20号元素 | |
| D. | 原子的种类和元素的种类一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
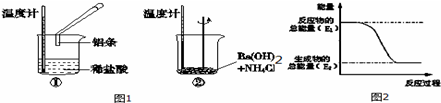
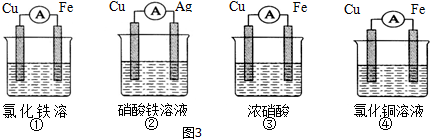
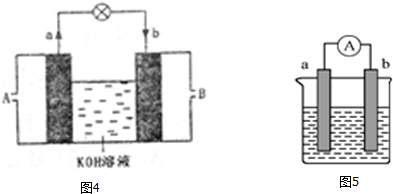
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.28mol | B. | 0.3lmol | C. | (n+0.2)mol | D. | (n+0.1)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氘(D)原子核外有2个电子 | B. | 1H与D互称同位素 | ||
| C. | H2与D2互称同素异形体 | D. | 18g D2O的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
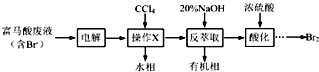

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
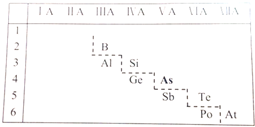
 ;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是60°.
;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是60°.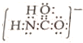 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com