
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 氢氧化铁胶体 | 铁 | 碳酸钙 |
| D | 水银 | 澄清石灰水 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正向反应速率减小,逆向反应速率增大 | |
| B. | 升高温度有利于正、逆反应速率增大,从而缩短达到平衡的时间 | |
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡逆向移动 | |
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
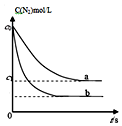 汽车尾气中,产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
汽车尾气中,产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | 若曲线b对应的条件改变是温度,可判断该反应的△H<0 | |
| B. | 温度T下,随着反应的进行,混合气体的密度减小 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 温度T下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{c}_{1}^{2}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定反应速率的主要因素有浓度、压强、温度 | |
| B. | 容量瓶、量筒个滴定管上都标有使用温度,容量瓶无“0”刻度,量筒、滴定管有“0”刻度;实验时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| C. | 为实验安全,金属钠切割下来的表层物质反应放回原试剂瓶,不能再研磨氯酸钾或硝酸钾 | |
| D. | 皂化反应结束后的混合液中加入饱和食盐水,再通过分液操作分离出硬质酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O$\frac{\underline{\;通电\;}}{\;}$ 2H2↑+O2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | Cl2+H2O═HC1+HC1O | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
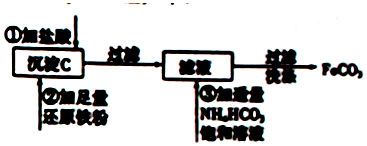
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
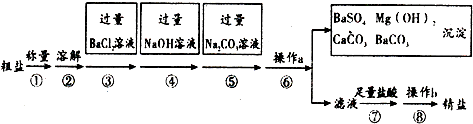
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com