

| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3o | 一60.75 |
| H2Se | 1.47 | 91.0o | 一41.50 |
| 编号 | I5/kJ·mol-1 | I6/kJ·mol-1 | I7/kJ·mol-1 | I8/kJ·mol-1 |
| A | 6990 | 9220 | 11500 | 18770 |
| B | 6702 | 8745 | 15455 | 17820 |
| C | 5257 | 6641 | 12125 | 13860 |


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
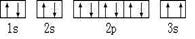 ,违背了 原理。
,违背了 原理。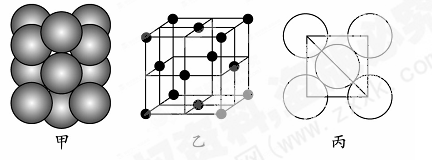
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 4FeCl2+N2O↑+6HCl+H2O
4FeCl2+N2O↑+6HCl+H2O

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ①A、B、C、D、E、F为短周期主族元素,原子半径大小关系为A<D<C<B<F<E; |
| ②A与D形成的化合物常温下为液态; |
| ③B元素原子价电子(外围电子)排布为nSnnPn |
| ④F元素原子的核外p电子总数比s电子总数多1; |
| ⑤第一电子能:F<E; |
| ⑥G的基态原子核外有6个未成对电子; |
⑦H能形成红色(或砖红色)的 和黑色的HD两种化合物。 和黑色的HD两种化合物。 |
 中B原子采取的杂化轨道类型为 。
中B原子采取的杂化轨道类型为 。 分子的空间构型为 。
分子的空间构型为 。 极易溶于
极易溶于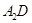 ,原因是 。
,原因是 。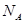 表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和
表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和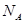 代数式表示)
代数式表示)
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配位体是Cl-和H2O,配位数是9 |
| B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ |
| C.内界和外界中的Cl-的数目比是1:2 |
| D.加入足量AgNO3溶液,所有Cl-均被完全沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| I1/KJ·mol-1 | I2/KJ·mol-1 | I3/KJ·mol-1 | I4/KJ·mol-1 | I5/KJ·mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |

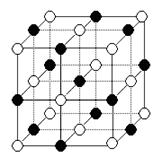
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com