
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| 0.1 | 0.1 | pH=9 |
| Kw |
| c(H+) |
| Kw |
| c(H+) |
| 10-14 |
| 10-9 |


科目:高中化学 来源: 题型:
| A、17种 | B、18种 |
| C、19种 | D、20种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第二周期元素氢化物稳定性的顺序是:HF>H2O,所以第三周期元素氢化物稳定性的顺序也是:HCl>H2S |
| B、IVA族元素氢化物熔点顺序是:SiH4>CH4,所以VA族元素氢化物熔点顺序也是:PH3>NH3 |
| C、第三周期元素的非金属性:Cl>S,所以其对应的氢化物水溶液的酸性也是:HCl>H2S |
| D、钠比铝活泼,工业上用电解熔融氯化钠制备钠,所以工业上也用电解熔融氯化铝制备铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用pH试纸检测,氨水溶液呈碱性:NH3?H2O?NH4++OH- |
| B、100℃时,测得纯水中c(H+)?c(OH-)=1×10-12:H2O(l)?H+(aq)+OH-(aq)△H<0 |
| C、FeCl3溶液中通入适量SO2,溶液黄色褪去:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| D、向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烧杯中的溶液呈棕黄色 |
| B、铜片无任何变化 |
| C、铜片上有凹陷的“Cu”字 |
| D、发生了反应:Fe3++Cu=Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
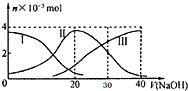 25℃时,向20mL 0.2mol/L H2A(某二元弱酸)溶液中滴加0.2mol/L NaOH溶液,有关微粒的物质的量变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)?根据图示判断,下列说法中正确的是( )
25℃时,向20mL 0.2mol/L H2A(某二元弱酸)溶液中滴加0.2mol/L NaOH溶液,有关微粒的物质的量变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)?根据图示判断,下列说法中正确的是( )| A、当V(NaOH)=20mL时,所得溶液中:c(OH-)>c(H+) |
| B、当V(NaOH)=30mL时,所得溶液中:2c(H+)+c(HA-)+3c(H2A)=c(A2-)+2 c(OH-) |
| C、当V(NaOH)=40mL时,所得溶液中:c(Na+)>c(A2-)>c(H+)>c(HA-)>c(OH-) |
| D、在NaHA溶液中:c(OH-)+2c(A2-)=c(H+)+2c(H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 物质 | 酒精 | 浓硫酸 | 汽油 | 氯酸钾 |
| 标签 |  |  |  |  |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com