
有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
科目:高中化学 来源: 题型:
下列说法正确的是
A.非金属氧化物一定为酸性氧化物
B.化合反应一定是有单质参加反应
C.向煮沸的1 mol·L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
D.医疗上的血液透析利用了胶体的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
水的电离平衡曲线如图所示:
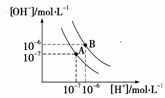
A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡到达B点。
(1)25℃时水的离子积为________________,100℃时水的离子积为________________。
(2)100℃时,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图装置进行铁粉在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题:
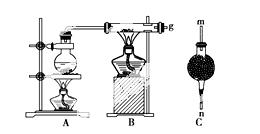
(1)写出铁在高温下与水蒸气反应的化学方程式: _______________________________。
(2)干燥管C内盛放的药品是________。干燥管的________(填“m”或“n”)端与导管口 g 相连接。
(3)若收集到标准状况下的H2为22.4 L,则参加反应的铁粉的质量为________g。
(4)当固体质量增加32 g时,生成H2的质量为________g。
g时,生成H2的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示物质间的相互转变关系,反应①在工业上可用来生产化 合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应.常温下,D、E、G均是
合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应.常温下,D、E、G均是 气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%.
气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%.

请回答下列问题:
(1)写出F的化学式:________________.
(2)写出G的电子式:________________.
(3)反应①的化学方程式为___________________,人们将反应①涉及的化学工业称为________.
(4)反应⑤的离子方程式为______________________________________________.
高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为:
①Na2FeO4具有强 氧化性可杀菌消毒;
氧化性可杀菌消毒;
②________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x的 值:__________________(列出计算过程)。
值:__________________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备。
查看答案和解析>>
科目:高中化学 来源: 题型:
浓硫酸和2 mol/L的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如图所示,分析a、b曲线变化的原因是 ( )
A.a升华、b冷凝
B.a挥发、b吸水
C.a蒸发、b潮解
D.a冷凝、b吸水
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨的反应是在500℃左右进行的,这主要是因为( )
A.500℃时此反应速率最快
B.500℃时NH3的平衡浓度最大
C.500℃时N2的转化率最高
D.500℃时该反应的催化剂活性最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com