
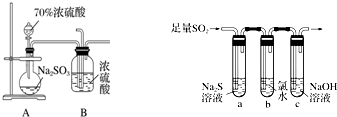
分析 (1)用分液漏斗向圆底烧瓶中滴加液体,应使分液漏斗和烧瓶内压强相等;
(2)二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应;
(3)氯气具有氧化性,可以将二氧化硫氧化到最高价的硫酸.
解答 解(1)分液漏斗的使用方法:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加;
故答案为:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加;
(2)二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应,生成淡黄色的沉淀S,故答案为:a试管中有淡黄色沉淀生成;
(3)方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成,可能是氯水中的氯离子产生的作用,
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去,可以是氯水中含有的漂白性物质次氯酸起的作用;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀,证明溶液中含硫酸根离子,是二氧化硫在酸性环境下被氯水氧化生成的,即SO2+Cl2+2H2O=4H++SO42-+2Cl-,S元素的化合价升高,体现二氧化硫的还原性,则实验设计合理,
故答案为:Ⅲ;SO2+Cl2+2H2O=4H++SO42-+2Cl-.
点评 本题考查二氧化硫的性质及实验设计,为高频考点,把握反应中元素的化合价变化及(2)中实验目的为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑥ | C. | ②⑤⑥ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2与Cl2混合后点燃与 H2 在Cl2中安静燃烧的反应速率是一样大的 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下硅性质活泼,可以与氯气、强酸、强碱溶液等起反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
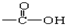 中的-OH被卤原子取代所得的化合物为酰卤,下列化合物中可以看作酰卤的是( )
中的-OH被卤原子取代所得的化合物为酰卤,下列化合物中可以看作酰卤的是( )| A. | HCOOH | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol•(L•s)-1 | B. | 0.3 mol•(L•s)-1 | C. | 0.2 mol•(L•s)-1 | D. | 0.1 mol•(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4与Cl2反应生成的四种有机产物常温下都是液体 | |
| B. | CH4、CCl4都是正四面体结构 | |
| C. | CH4是天然气、沼气、水煤气、坑道气的主要成分 | |
| D. | CH4通常情况下性质稳定,但可以和氯水在光照条件下发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数B>A>C | B. | 原子半径A>B>C | ||
| C. | 离子半径A2->B2+>C- | D. | 原子最外层电子数C>A>B |
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:选择题
a mol FeS和b mol Fe3O4投入到VL c mol/L的硝酸溶液中恰好完全反应,假设只产生标准状况2.24 L NO气体,溶液中只有Fe(NO3)3和H2SO4的混合液,向溶液中逐渐滴入c′ mol/L NaOH溶液,则当沉淀达最大时,消耗NaOH溶液的体积是
A. L B.
L B. L C.
L C. D .
D . L
L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com