
【题目】自来水常用Cl2消毒,某学生在实验室用这种自来水去配制下列物质的溶液,不会产生明显药品变质问题的是( )
① NaBr ② FeCl3 ③ Na2SO3 ④ AlCl3 ⑤ FeSO4 ⑥ NaHCO3
A.①③ B.②④ C.③④⑥ D.②③④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】密闭容器中加入4 mol A、1.2 mol C和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知t0~t1阶段保持恒温、恒容,且c(B)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件,其中t3时刻为使用催化剂。
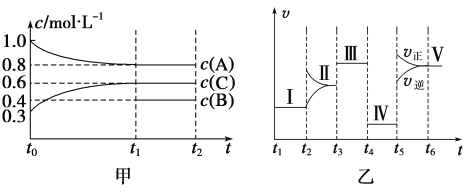
(1)若t1=15 s,则t0~t1阶段的反应速率为v(C)=___________。
(2)t4时刻改变的条件为____________,B的起始物质的量为______________。
(3)t5时刻改变的条件为_____________,该反应的逆反应为__________(填“吸热反应”或“放热反应”)。
(4)图乙中共有Ⅰ~Ⅴ五处平衡,其平衡常数最大的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
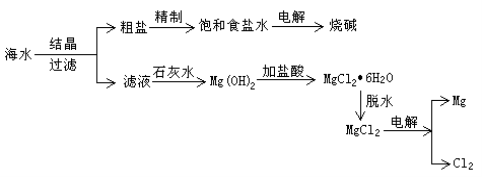
⑴ 在实验室对海水进行过滤,所需要玻璃仪器为烧杯、漏斗和 ,补填的玻璃仪器在过滤时,起到了 的作用。
⑵ 若粗盐中仅含有Ca2+、Mg2+两种杂质离子。精制提纯时,备用的除杂试剂有:(A.盐酸 B.Na2CO3溶液 C.NaOH溶液)请你正确排列加入的顺序:( )、( )、( )(填编号)
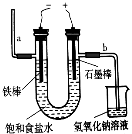
⑶ 用如图电解食盐水,石墨电极上产生的气体为 ;在铁棒周围的溶液里滴加酚酞,溶液变 色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________,D原子的杂化类型为_______________。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________(填“大于”、“小于”、或“等于”)N的沸点,原因是_______________。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________。写出相应的化学反应方程式:____________________。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________,加入乙醇的作用是________________。
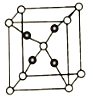
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______g.cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是()
A.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=4NH4++AlO2-+2H2O
B.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:
2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
C.NO2与水的反应:3NO2+H2O=2HNO3+NO
D.工业冶炼金属钠:2NaCl![]() 2Na+Cl2↑
2Na+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1).制取MgCl2的过程中涉及反应:MgCl2.6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________________。
(2).在实验室模拟氯碱工业电解饱和食盐水,用玻璃棒蘸浓氨水检验阳极产生的气体,生成大量白烟。写出化学方程式____________________。直接电解氯化钠稀溶液可制备“84”消毒液,所得消毒液仅含一种溶质,写出相应的化学方程式:___________________,下列措施能增强“84”消毒液杀菌能力的是___________(填序号)
A.加入适量醋酸b.加入适量亚硫酸
c.加入少量NaOH粉末D.加入适量的稀盐酸
(3).生活中常用ClO2净化自来水,将SO2通入硫酸酸化的KClO3可以制备ClO2,氧化剂和还原剂的物质的量之比为__________。有效氯含量可以来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为__________(结果保留小数点后1位)。
(4).某学习小组探究过氧化钠和二氧化硫的化学反应,有同学认为类似于过氧化钠和二氧化碳的反应,有同学认为二氧化硫全被氧化,现向过氧化钠中通入足量的二氧化硫,请设计实验证明二氧化硫部分被氧化:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,甲容器中充满35Cl2,乙容器中充满37Cl2,下列叙述不正确的是( )
A.若两种气体体积相等,甲、乙两容器中气体的密度之比为35∶37
B.若两种气体体积相等,甲、乙两容器中气体分子数之比为35∶37
C.若两种气体质量相等,甲、乙两容器中气体所含质子数之比为37∶35
D.若两种气体体积相等,甲、乙两容器中气体所含中子数之比为9∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号中的试剂除去各组中的杂质,不正确的是( )
A. 苯中的甲苯(溴水) B. 乙醇中的水(新制CaO)
C. 乙醛中的乙酸(NaOH) D. 乙酸乙酯中的乙酸(饱和Na2CO3溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一固定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2![]() 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题(计算结果保留一位小数):
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题(计算结果保留一位小数):
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.向装置中再充入SO3
(3)求该反应达到平衡时SO2的转化率为(用百分数表示) 。
(4)若将平衡混合气体的5%通入过量的Ba(OH)2溶液,生成沉淀 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com