
分析 铵根离子中含有10个电子、11个质子,则1mol铵根离子中含有10mol电子、11mol质子;水分子中含有10个电子,0.5mol水分子中含有5mol电子,最后根据N=nNA进行计算即可.
解答 解:1mol NH4+含有10mol电子、11mol质子,则1mol铵根离子所含电子数为10NA,含有的质子数为11NA;
0.5 mol H2O中含有5mol电子,则含有0.5NA个电子,
故答案为:10NA;11NA;0.5NA.
点评 本题考查了物质的量的计算,题目难度不大,注意掌握物质的量与摩尔质量、阿伏伽德罗常数之间的关系,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | O2+C$\frac{\underline{\;高温\;}}{\;}$CO2 | B. | 2NaOH+CO2═Na2CO3+H2O | ||
| C. | 2Na2O2+CO2═2Na2CO3+O2 | D. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一次与100ml稀硝酸反应剩4.8g金属为Cu和Fe | |
| B. | 反应前稀硝酸的物质的量的浓度为1.5 mol•L-1 | |
| C. | 若向上述最后所得溶液中再加入足量的稀硝酸还可得到标况下0.56LNO | |
| D. | 原混合物中Cu和Fe的物质的量分别为0.06mol和0.09mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 组成元素相同,分子结构不同 | |
| B. | 组成元素的质量分数相同,只有化学性质不同 | |
| C. | 具有相同分子量而结构不同 | |
| D. | 具有相同分子量,且组成元素及组成元素的质量分数相同,只是结构不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
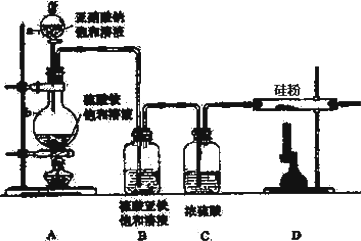
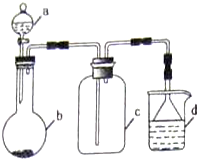
| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Fe | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.2×10-10 mol/L | B. | 2.2×10-12 mol/L | C. | 2.2×10-14 mol/L | D. | 1.1×10-21 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com