
下列关于丙烯(CH3﹣CH=CH2)的说法正确的( )
|
| A. | 丙烯分子有8个σ键,1个π键 |
|
| B. | 丙烯分子中3个碳原子都是sp3杂化 |
|
| C. | 丙烯分子不存在非极性键 |
|
| D. | 丙烯分子中3个碳原子在同一直线 |
考点:
共价键的形成及共价键的主要类型;极性键和非极性键;原子轨道杂化方式及杂化类型判断.
专题:
化学键与晶体结构.
分析:
A.C﹣C、C﹣H键均为σ键,C=C中一个σ键,一个π键;
B.甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化;
C.同种非元素之间形成非极性键;
D.由C=C双键为平面结构、甲基为四面体结构分析.
解答:
解:A.C﹣C、C﹣H键均为σ键,C=C中一个σ键,一个π键,则丙烯分子有8个σ键,1个π键,故A正确;
B.甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化,则丙烯分子中1个碳原子是sp3杂化,2个碳原子是sp2杂化,故B错误;
C.同种非元素之间形成非极性键,则丙烯中存在C﹣C非极性共价键,故C错误;
D.由C=C双键为平面结构、甲基为四面体结构可知,丙烯分子中2个碳原子在同一直线,故D错误;
故选A.
点评:
本题考查共价键及分类,注意判断共价键的规律和常见有机物的空间结构来解答,杂化类型为解答的易错点,题目难度不大.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,不正确的是( )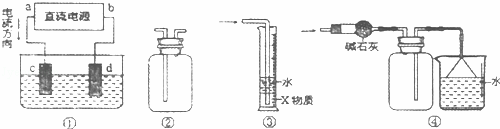
|
| A. | 装置①中,c为阳极,d为阴极 |
|
| B. | 装置②可用于排空气法收集H2、NH3、Cl2、HCl、NO等 |
|
| C. | 装置③中X为四氯化碳,可用于吸收氨气或氯化氢 |
|
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
欲配制100mL 1.0mol/L Na2SO4溶液,正确的方法是( )
①将14.2g Na2SO4溶于100ml水中
②将32.2g Na2SO4•10H2O溶于少量水中,再用水稀释至100ml
③将20mL 5.0mol/L Na2SO4溶液用水稀释至100ml.
A. ①② B. ②③ C. ①③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
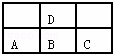
如图是元素周期表短周期的一部分,若A原子最外层的电子数比次外层的电子数少3,则下列说法中正确的是( )
|
| A. | D与C不能形成化合物 |
|
| B. | D的最高正价与B的最高正价相等 |
|
| C. | A、B、C的最高价氧化物对应的水化物酸性强弱的关系是C>B>A |
|
| D. | A、B、C、D原子所具有的原子轨道类型和数目都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化或数据与氢键无关的是( )
|
| A. | 水凝结成冰时,密度变小 |
|
| B. | 氨分子与水分子形成一水合氨 |
|
| C. | 水在2000℃时,只有4%的H2O发生分解 |
|
| D. | SbH3的沸点比PH3高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl﹣物质的量浓度相同的是( )
|
| A. | 100mL 0.5mol/L MgCl2溶液 |
|
| B. | 200mL 0.25mol/L CaCl2溶液 |
|
| C. | 50ml 1mol/L NaCl溶液 |
|
| D. | 25ml 2mol/L HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素及其化合物性质的比较正确的是( )
|
| A. | 原子半径:F<O<Al | B. | 稳定性:H2O<PH3<NH3 |
|
| C. | 酸性:H2CO3<H2SO4<H3PO4 | D. | 碱性:LiOH<NaOH<Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com