
| A. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| B. | 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 | |
| C. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 | |
| D. | 我国神舟系列飞船所用太阳能电池板可将光能转换为电能,所用转换材料是晶体硅 |
分析 A.煤的综合利用的方法有气化、液化和干馏;
B.氯气和碱反应生成氯化物、次氯酸物和水;
C.根据铝的化学性质比较活泼,可以和空气中的氧气反应生成氧化铝,在铝的表面形成一层致密的氧化物薄膜,从而表现出良好的抗腐蚀性能;
D.晶体硅为良好的半导体材料,可以制造太阳能电池.
解答 解:A.煤的综合利用的方法有气化、液化和干馏,经气化可以获得水煤气,经液化可以获得甲醇,经干馏可以获得芳香烃和粗氨水等,故可以获得清洁原料和重要的化工原料,故A正确;
B.氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,次氯酸钠和次氯酸钙都可以反应生成次氯酸,次氯酸具有氧化性,可以杀菌消毒,故B正确;
C.因铝的化学性质比较活泼,可以和空气中的氧气反应生成氧化铝,在铝的表面形成一层致密的氧化物薄膜,从而表现出良好的抗腐蚀性能,不是因为常温下铝不能与氧气反应,故C错误;
D.我国神舟系列飞船所用太阳能电池板可将光能转换为电能,所用转换材料是晶体硅,故D正确;
故选:C.
点评 本题考查了物质的用途、物质的性质及制法,煤的深加工处理方法,明确物质的性质是解本题关键,注意煤与石油的加工方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 制备硫酸:使用热交换器可以充分利用能量 | |
| B. | 侯德榜制碱:析出NaHCO3的母液中加入消石灰,可以循环利用NH3 | |
| C. | 合成氨:采用500℃的高温,有利于增大反应正向进行的程度 | |
| D. | 合成氯化氢:通入H2的量略大于Cl2,可以使平衡正移 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2
现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙二醛(OHC-CHO)是一种重要的精细化工产品.工业用乙二醇(HOCH2CH2OH)氧化法生产乙二醛.
乙二醛(OHC-CHO)是一种重要的精细化工产品.工业用乙二醇(HOCH2CH2OH)氧化法生产乙二醛. +2NH2OH•HCl→
+2NH2OH•HCl→ +2HCL+2H2O)
+2HCL+2H2O)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O═H++OH- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHS═Na++HS- | D. | HCO3-═H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | Na+ | Mg2+ | Ca2+ | K+ | Li+ | Cl- | SO42- | Br- |
| 含量/mg•L-1 | 9965 | 1200 | 400 | 380 | 0.17 | 19350 | 1200 | 67 |
| 实验操作 | 实验现象 |
| Ⅰ.取1mL海水,加入1mL0.1mol/L的NaOH溶液 | 有白色沉淀 |
| Ⅱ.取1mLCaCl2溶液,加入1mL0.1mol/L的NaOH溶液 | 无白色沉淀 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示HCl的形成过程: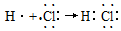 | |
| B. | ${\;}_{87}^{166}$Ho中的原子核内的中子数与核外电子数之差是99 | |
| C. | 在空气中加热金属锂:4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O | |
| D. | Na2O2与H2O2中所含的化学键类型不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丙醇与浓氢溴酸反应:CH3CH2CH2OH+HBr $\stackrel{△}{→}$CH3CH2CH2Br+H2O | |
| B. | 服用阿司匹林过量出现水杨酸(  )中毒反应,可静脉注射 NaHCO3溶液: )中毒反应,可静脉注射 NaHCO3溶液: +2 HCO3-→ +2 HCO3-→ +2 CO2↑+2 H2O +2 CO2↑+2 H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 向丙氨酸钠中加入足量盐酸: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com