
| A. | 质量 | B. | 密度 | C. | 原子数 | D. | 物质的量 |
分析 同温同压下,气体摩尔体积相等,体积相等的不同气体其物质的量相等,根据V=nVm、ρ=$\frac{M}{{V}_{m}}$、m=nM及分子构成计算.
解答 解:同温同压下,气体摩尔体积相等,体积相等的不同气体其物质的量相等,
A.盛有H2和Cl2的混合气体的容器中两种气体的物质的量的关系不知道,所以不能求出混合气体的质量,则二者的质量不一定相等,故A错误;
B.根据ρ=$\frac{M}{{V}_{m}}$知,密度与其摩尔质量成正比,两个容器中平均摩尔质量不一定相等,所以其密度不一定相等,故B错误;
C.根据V=nVm知,同温同压下,气体摩尔体积相等,二者的物质的量相等,分子式相等,则原子数不同,故C错误;
D.根据V=nVm知,同温同压下,气体摩尔体积相等,二者的物质的量相等,故D正确;
故选D.
点评 本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系是解本题关键,熟记基本公式并灵活运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
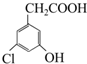
| A. | 具有4个官能团,氯原子、苯基、羟基和羧基 | |
| B. | 具有羧基,能与醇类物质发生酯化反应 | |
| C. | 具有酚羟基,所以能与NaHCO3溶液反应生成CO2 | |
| D. | 具有氯原子,在氢氧化钠醇溶液中加热,可发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯固定的熔沸点,其可由乙烯通过加聚反应合成 | |
| B. | 有机物的种类繁多,分子中含有碳、氢元素的物质即为有机物 | |
| C. | 石油的分馏和煤的干馏均属于物理变化 | |
| D. | 不是所有的有机物中都含有一种或多种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 饱和Na2CO3溶液 | B. | NaOH稀溶液 | C. | 饱和Ca(OH)2溶液 | D. | CaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
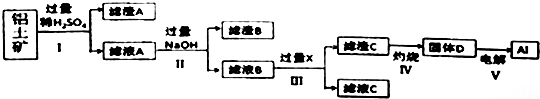
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
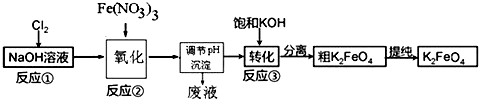
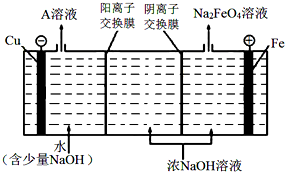
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

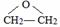 、DClCH2CH2OCH2CH2Cl.
、DClCH2CH2OCH2CH2Cl.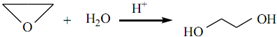 ;反应②ClCH2CH2OCH2CH2Cl+2KOH$→_{△}^{乙醇}$CH2=CH-O-CH=CH2+2KCl+2H2O.
;反应②ClCH2CH2OCH2CH2Cl+2KOH$→_{△}^{乙醇}$CH2=CH-O-CH=CH2+2KCl+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com