
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为Mg/mol.若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为 .
(2)该气体在标准状况下的体积为
(3)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 .
(4)该气体溶于水后形成V L溶液,其溶液中溶质的物质的量浓度为 .
【答案】
(1)![]()
(2)![]() L
L
(3)![]() %
%
(4)![]() mol/L
mol/L
【解析】解:(1)mg该气体的物质的量为:n= ![]() mol,含有原子的物质的量为=
mol,含有原子的物质的量为= ![]() mol×2=
mol×2= ![]() mol,该气体所含原子总数为:N=
mol,该气体所含原子总数为:N= ![]() ×NA=
×NA= ![]() ,所以答案是:
,所以答案是: ![]() ;(2)mg该气体在标准状况下的体积为:V=n×22.4L/mol=22.4L/mol×
;(2)mg该气体在标准状况下的体积为:V=n×22.4L/mol=22.4L/mol× ![]() mol=
mol= ![]() L,所以答案是:
L,所以答案是: ![]() L;(3)该气体溶于1L水中(不考虑反应),1L水的质量约为1000g,则该溶液中溶质的质量分数为:ω=
L;(3)该气体溶于1L水中(不考虑反应),1L水的质量约为1000g,则该溶液中溶质的质量分数为:ω= ![]() ×100%=
×100%= ![]() %,所以答案是:
%,所以答案是: ![]() %;(4)该气体溶于水后形成V L溶液,其溶液中溶质的物质的量浓度为:c=
%;(4)该气体溶于水后形成V L溶液,其溶液中溶质的物质的量浓度为:c= ![]() =
= ![]() mol/L=
mol/L= ![]() mol/L,所以答案是:
mol/L,所以答案是: ![]() mol/L.
mol/L.


科目:高中化学 来源: 题型:
【题目】利用从冬青中提取出的有机物A合成抗结肠炎药物Y及其他化学品的合成路线如下: 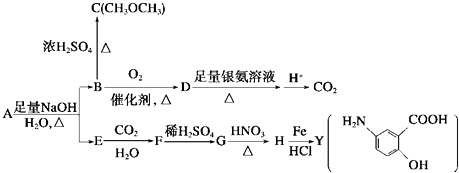
提示: ![]()
根据上述信息回答:
(1)D不与NaHCO3溶液反应,D中官能团的名称是 , B→C的反应类型是 .
(2)写出A生成B和E的化学反应方程式: .
(3)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下,I和J分别生成 ![]() 和
和 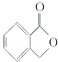 ,鉴别I和J的试剂为 .
,鉴别I和J的试剂为 .
(4)A的另一种同分异构体K用于合成高分子材料,K可由 ![]() 制得,写出K在浓硫酸作用下生成的聚合物的结构简式: .
制得,写出K在浓硫酸作用下生成的聚合物的结构简式: .
(5)写出B生成C的化学反应方程式: .
(6)写出B生成D的化学反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有转化关系(其他产物及反应所需条件均已略去).
A ![]() B
B ![]() C
C ![]() D
D ![]() E
E ![]() F,以下推断错误的是( )
F,以下推断错误的是( )
A.当X是盐酸时,则F是稀硝酸
B.当X是氢氧化钠时,则F是稀硝酸
C.当X是氢氧化钠时,B跟Cl2反应可能有白烟现象
D.当X是氢氧化钠时,B能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象描述正确的是

A. 逸出气体的体积,a电极的小于b电极的
B. 一电极逸出无味气体,另一电极逸出刺激性气体
C. a电极附近呈红色,b电极附近呈蓝色
D. a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得: 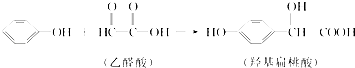
下列有关说法正确的是( )
A.苯酚和羟基扁桃酸互为同系物
B.羟基扁桃酸分子中至少有12个原子共平面
C.乙醛酸在核磁共振氢谱中只有1个吸收峰
D.常温下,1 mol羟基扁桃酸只能与1 mol Br2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为molL﹣1 .
(2)现用该浓盐酸配制100mL 1molL﹣1的稀盐酸.可供选用的仪器有:
①胶头滴管 ②烧瓶 ③烧杯 ④药匙
⑤量筒 ⑥托盘天平
配制稀盐酸时,上述仪器中需要使用的有(选填序号),还缺少的仪器有(写仪器名称).
(3)配制100mL 1molL﹣1的稀盐酸需要用量筒量取上述浓盐酸的体积为mL(保留一位小数),量取浓盐酸时应选用(选填①10mL ②50mL ③100mL)规格的量筒.
(4)实验中造成所配溶液浓度偏高的原因可能是 .
A.未经冷却,立即转移至容量瓶并洗涤烧杯,定容
B.用量筒量取液体时仰视读数
C.烧杯没有洗涤
D.某同学在定容观察液面时俯视
E.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
F.容量瓶中原来含有少量蒸馏水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2 , 装置如图1所示.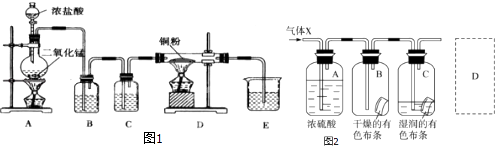
请回答下列问题:
(1)B中选用的试剂是饱和食盐水,其作用是;C中选用的试剂是 , 其作用是 .
(2)D中反应的化学方程式是 , 将此生成物溶于少量水,得到色溶液.
(3)某学生应用如图2所示的方法研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气.回答下列问题:①该项研究(实验)的主要目的是 .
②与研究目的直接相关的实验现象是 .
③从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是 .
④请在图中的D处以图的形式表明克服事故隐患的措施 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.0.1molL﹣1的NaCl溶液中,Na+与Cl﹣离子总数为0.2NA
B.标准状况下,2.24L水的质量是1.8g
C.16gO3比16gO2所含的氧原子数多
D.22gCO2与标准状况下11.2L Cl2含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
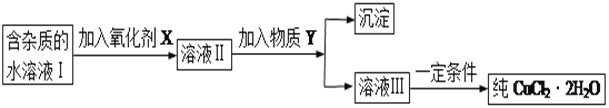
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是____________________________________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________________________________。
(3)含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() ,为了使废水的排放达标,进行如下处理:
,为了使废水的排放达标,进行如下处理:
![]()
①绿矾化学式为FeSO4·7H2O,反应(I)的离子方程式为________________________________;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com