
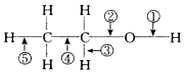
| A. | 与浓硫酸混合加热至170℃,断②⑤ | B. | 与氢卤酸反应断② | ||
| C. | 分子间脱水断①或② | D. | 与醋酸反应断② |
分析 A.乙醇和浓H2SO4共热至170℃时发生消去反应,断裂碳氧键、与羟基所连的碳的相邻的碳上的碳氢键;
B.乙醇和浓氢溴酸混合加热,发生取代反应;
C.乙醇和浓H2SO4共热至140℃时,发生分子间脱水,断开的是羟基上的氢氧键、碳氧键;
D.酯化反应中,酸去羟基,醇去氢.
解答 解:A.乙醇和浓H2SO4共热至170℃时,发生消去反应,生成乙烯,反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,故乙醇断键的位置为:②和⑤,故A正确;
B.乙醇与浓氢溴酸反应,生成溴乙烷和水,乙醇断裂②键,故B正确;
C.乙醇和浓H2SO4共热至140℃时,发生分子间脱水2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O,故乙醇断键的位置为①和②,故C正确;
D.与醋酸、浓硫酸共热时,发生酯化反应,醇脱H,O-H键断裂,即键①断裂,故D错误.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醇性质的考查,注意发生的反应及化学键的断裂位置,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)<c(Na+) | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 足量锌分别和等体积、等物质的量浓度的盐酸和醋酸反应时产生H2的量相等,放出H2的速率不等 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯、天然橡胶都是由高分子化合物组成的物质 | |
| B. | 用高锰酸钾溶液不可以鉴别直馏汽油和裂化汽油 | |
| C. | 有机物均含有C元素,但不是所有有机物均能发生燃烧反应 | |
| D. | 煤的气化、液化、干馏都属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按要求回答下列问题:
按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
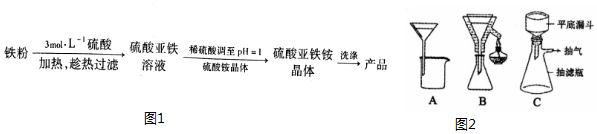
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 70℃ |
| FeSO4•7H2O | 28.8 | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4 | 70.6 | 73 | 75.4 | 78.0 | 81 | 84.5 | 94.9 |
| (NH4)2SO4•FeSO4•6H2O | 14.5 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com