
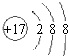
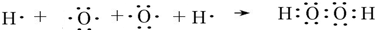
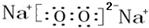 ,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1molH发生该反应转移电子数为6.02×1023
,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1molH发生该反应转移电子数为6.02×1023 分析 A、B、C、D、E、F为短周期元素且原子序数依次增大,常温下D2是气体,标况时D2气体的密度约是1.43g/L,则其相对分子质量为1.43×22.4=32,则D为O元素;A的最高正价与最低负代数和为零,则A处于ⅠA族或ⅣA族,原子序数比氧的至少小3,故A为氢元素;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应,B、C原子序数都小于氧,故X为碳酸的铵盐,可能为正盐碳酸铵或酸式盐碳酸氢铵,则B为碳元素、C为N元素;E原子半径在同周期中除稀有气体外最大,处于IA族,原子序数大于氧,则E为Na;F原子M层上的电子比K层多5个,最外层电子数为7,故F为Cl元素;G的合金在生活中用量最大,用途最广,该合金为钢,则G为Fe元素,据此进行解答.
解答 解:A、B、C、D、E、F为短周期元素且原子序数依次增大,常温下D2是气体,标况时D2气体的密度约是1.43g/L,则其相对分子质量为1.43×22.4=32,则D为O元素;A的最高正价与最低负代数和为零,则A处于ⅠA族或ⅣA族,原子序数比氧的至少小3,故A为氢元素;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应,B、C原子序数都小于氧,故X为碳酸的铵盐,可能为正盐碳酸铵或酸式盐碳酸氢铵,则B为碳元素、C为N元素;E原子半径在同周期中除稀有气体外最大,处于IA族,原子序数大于氧,则E为Na;F原子M层上的电子比K层多5个,最外层电子数为7,故F为Cl元素;G的合金在生活中用量最大,用途最广,该合金为钢,则G为Fe元素.
(1)G为Fe,在元素周期表中的位置是:第四周期第Ⅷ族,F为Cl,离子结构示意图为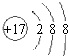 ,
,
故答案为:第四周期第Ⅷ族;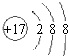 ;
;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故D、E、F离子半径由大到小顺序为:Cl->O2->Na+,
故答案为:Cl->O2->Na+;
(3)A与D可形成原子个数比为1:1的化合物为H2O2,用电子式表示该化合物的形成过程: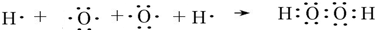 ,
,
故答案为: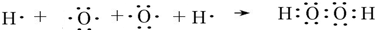 ;
;
(4)D与E形成某离子化合物H具有漂白性,则H为Na2O2,电子式为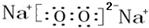 ,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1mol过氧化钠发生该反应生成0.5mol氧气,转移1mol电子,故转移电子数为6.02×1023 ,
,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1mol过氧化钠发生该反应生成0.5mol氧气,转移1mol电子,故转移电子数为6.02×1023 ,
故答案为: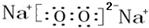 ;2Na2O2+2CO2=2Na2CO3+O2;6.02×1023 ;
;2Na2O2+2CO2=2Na2CO3+O2;6.02×1023 ;
(5)X为正盐,则X为碳酸铵,含有离子键、共价键,碳酸铵加热分解生成氨气、二氧化碳气体和水,反应的化学方程式为:(NH4)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+H2O+CO2↑,
故答案为:离子键、共价键; (NH4)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+H2O+CO2↑;
(6)碳和氯两种元素相比较,原子得电子能力较强的为氯,
a.单质的沸点属于物理性质,不能比较得电子能力强弱,故a错误;
b.二者形成的化合物中,F(氯)元素的原子显负价,说明氯元素对键合电子吸引更强,则Cl原子得电子能力更强,故b正确;
c.非金属性与氢化物稳定性一致,非金属性越强,得电子能力越强,故c正确,
故答案为:Cl;bc;
(7)金属元素G可与F形成化合物FeCl3.将Fe的单质与石墨用导线相连浸入FeCl3溶液中形成一个原电池,
该原电池工作时,石墨为正极,发生还原反应,电极反应式为:2Fe3++2e-═2Fe2+,根据电子转移守恒,当有1.2mol e-转移时,参加反应的Fe为$\frac{1.2mol}{2}$=0.6mol,故单质Fe质量变化为0.6mol×56g/mol=33.6g
故答案为:2Fe3++2e-═2Fe2+;33.6;
(8)氢气、氧气制成电池,电池中装有KOH浓溶液,氢气发生氧化反应、氧气发生还原反应,在甲极通入氢气,乙极通入氧气,则甲为负极,乙为正极,甲极上是氢气失去电子,碱性条件下生成水,电极反应式为:H2-2e-+2OH-=2 H2O,
故答案为:H2-2e-+2OH-=2 H2O.
点评 本题考查了位置结构与性质关系的综合应用,题目综合性强,推断各元素为解答关键,熟练掌握基础知识,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 质子数:c<b | B. | 氢化物的还原性:H2Y>HZ | ||
| C. | 原子半径:X<W | D. | 离子的氧化性:X+<W3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4的球棍模型示意图为: | B. | 乙烯的实验式为:CH2 | ||
| C. | 乙醇的结构简式:C2H5OH | D. | 2-乙基-1,3-丁二烯分子的键线式: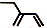 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| B. | 物质发生化学变化一定伴随着能量变化,且能量形式只表现为热量变化 | |
| C. | 把石墨完全转化为金刚石时,要吸收能量,所以石墨不如金刚石稳定 | |
| D. | 原子结合成分子的过程一定释放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IA族元素的金属性比第IIA族元素的金属性强 | |
| B. | 原子最外层只有2个电子的元素一定是第ⅡA元素 | |
| C. | 碱金属的熔点和密度都是随着原子序数的增大而增大 | |
| D. | 如果发现了原子序数为117号元素,它应该属于金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ②③⑥ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com