
| A、X、M两种元素形成的化合物只能存在离子键 |
| B、元素Y、Z、W的单质晶体属于同种类型的晶体 |
| C、由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
| D、元素W和M的某些单质可作为水处理中的消毒剂 |


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
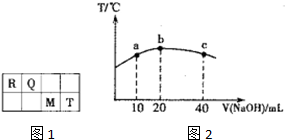 短周期元素R、Q、M、T在元素周期表中的相对位置如图1,已知R原子最外层电子数与次外层电子数之比为2:1.
短周期元素R、Q、M、T在元素周期表中的相对位置如图1,已知R原子最外层电子数与次外层电子数之比为2:1.| +X |
| +X |
| 化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | |||
| B | C | D |
| 催化剂 |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中滴加FeCl3的稀溶液,以制备Fe(OH)3胶体 |
| B、用盐酸滴定氢氧化钠,用酚酞作指示剂,当锥形瓶中溶液由无色变成红色时即达到滴定终点 |
| C、室温下,用pH试纸测定浓度为0.1 mol?L-1 NaClO溶液和0.1 mol?L-1 CH3COONa溶液的pH,比较HClO和CH3COOH的酸性强弱 |
| D、室温下,向Mg(OH)2中加入饱和氯化铵溶液能使Mg(OH)2溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com