
��һ���¶���ij�ܱ�������,���淴ӦA(g)+3B(g)  2C(g)+2D(s)�ﵽƽ�⣬��������һ����ȷ����
2C(g)+2D(s)�ﵽƽ�⣬��������һ����ȷ����
��C������������C�ķֽ�������� �ڵ�λʱ��������amolA,ͬʱ����3amolB
��A��B��C��Ũ�Ȳ��ٱ仯 �ܷ�Ӧ���ת���ʲ��ٱ仯
�ݻ�������ѹǿ���ٱ仯 �����������ʵ������ٱ仯
�ߵ�λʱ��������amolA,ͬʱ���� 3amolB ��A��B��C��D�ķ�����֮��Ϊ1:3:2:2
A�� �٢ڢۢܢݢޢ� B���٢ۢܢݢޢ�
C���٢ۢܢޢ� D���٢ۢݢޢߢ�
C
�����������������һ�����淴Ӧ����ﵽ��ѧƽ��״̬������������Ӧ�������淴Ӧ������ȣ������ʵ�Ũ�ȱ��ֲ��䡣�������ʽǶ�ȥ���������������ķ�Ӧ�������ķ�Ӧ������ˢ٢���ȷ���������������淴Ӧ��������Ǵ���ġ��ۢܢ���˵�������ʵ�Ũ�ȱ��ֲ��䡣�����ڢݣ���Ӧ��������������壬������Ҳ������������壬��������Ƿ�ƽ�⣬��������ѹǿҲ�DZ��ֲ���ģ�����Ǵ���ġ�����˵����һ�����淴Ӧ���ﵽƽ��״̬�������ʵ�Ũ�ȱ��ֲ��䣬�����Ǹ����ʵķ�����֮�ȵ���ϵ���ȡ�����Ǵ���ġ����Դ�ѡC
���㣺���黯ѧƽ��״̬�жϵ����֪ʶ��


 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
���仯���������{�ºϽ�ҵ���������졢�{��ȼ�ϵȷ���Ӧ�ù㷺��
��1����������һ�����²��ϣ���֪��ط�Ӧ���Ȼ�ѧ����ʽ���£�
2B(s)+N2(g)= 2BN(s) ��H="a" kJ ? mol-1
B2H6 (g)=2B(s) + 3H2 (g) ��H =b kJ ? mol-1
N2 (g) + 3H2 (g) 2NH3 (g) ��H ="c" kJ? mol-1
2NH3 (g) ��H ="c" kJ? mol-1
�ٷ�ӦB2H6(g)+2NH3(g)=2BN(s)+6H2(g) ��H = (�ú�a��b��c�Ĵ���ʽ��ʾ)kJ ��mol-1��
��B2H6��һ���{��ȼ�ϣ�д������Cl2��Ӧ���������Ȼ���Ļ�ѧ����ʽ�� ��
��2�����һЩ������Ķ������������ܵ����ǵĹ�ע��
�����������ѧ�ҽ��������͵��ᷢ����̼������������ɫ���ȴ�ͳ������ᱵ������ȫ��̼�����������������Ϊ78. 6%����̼����Ļ�ѧʽΪ ��
�ڽ��������ǽ�LiBH4��LiNH2��ĥ���Ͽ��γ��µĻ�����Li3BN2H8��Li4BN3 H10��Li3BN2H8��ĥ�ǰ����ʵ���֮��n(LiNH2) : n(LiBH4) =" 2" : 1������ĥ�γɵģ���Ӧ�����е�X����ͼ����ͼ��ʾ��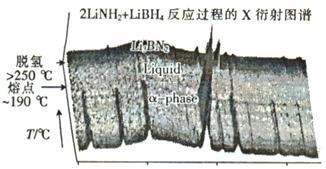
Li3BN2H8�ڴ���250��ʱ�ֽ�Ļ�ѧ����ʽΪ ��Li3BN2H8��Li4BN3H10�����ʵ�����ͬʱ����ַֽ⣬�ų�������H2��Li4BN3 H10�ֽ�ʱ�����������Li2NH����һ�����壬�������� ��
��3��ֱ�����⻯��ȼ�ϵ�ص�ԭ����ͼ�������ĵ缫��ӦʽΪ ������ܷ�Ӧ�����ӷ���ʽΪ ��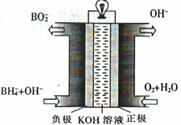
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�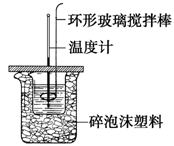
����һ������Ͳ��ȡ50ml 0.50 mol?L��1���ᵹ��С�ձ��У���������¶�t1��
�����������һ��Ͳ��ȡ50ml 0.55 mol?L��1 NaOH��Һ��������һ�¶ȼƲ�����¶�t2��
����������NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ���û��Һ����¶�t3��
�ش��������⣺
��1���������е���NaOH��Һ����ȷ������__________��
A���ز������������� B���������������� C��һ��Ѹ�ٵ���
��2��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������________������ţ���
A����������ձ� B���ҿ�ӲֽƬ�ò���������
C�����¶ȼ�С�Ľ��� D���������¶ȼ��ϵĻ��β������������ؽ���
��3��___________����ܡ����ܡ�����Ba��OH��2��Һ���������NaOH��Һ��������к��ȣ�������________________________________________��
��4���ڷ�Ӧ������Ϊ�з��������������HCl�ڷ�Ӧ�лӷ������õ��к���_______���ƫ����ƫС�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��Ӧ3X(g)+Y(g) 2Z(g)+2W(g)��2L�ܱ������н��У�5min��Y������0.5mol����˷�Ӧ��ƽ�����ʦ�Ϊ( )
2Z(g)+2W(g)��2L�ܱ������н��У�5min��Y������0.5mol����˷�Ӧ��ƽ�����ʦ�Ϊ( )
| A����(X)��0.05mol��L��1��min��1 | B����(Y)�� 0.10mol��L��1��min��1 |
| C����(Z)��0.10mol��L��1��min��1 | D����(W)��0.05mol��L��1��s��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����Zn����50ml�� 0��1mol/L��ϡ�����ַ�Ӧ��Ϊ�˼����˷�Ӧ���ʶ����ı�H2�IJ���������ʹ�����·����еģ� ��
�ټ�Na2SO4��Һ���ڸ���50ml��0��1mol/L��ϡ����۸���50ml��0��05mol/L�����
�ܼ�������������ƣ��ݼ�ѹ���ޱ�ˮԡ����NaCO3��Һ���ിZn��Ϊ������Zn
| A���٢ܢ� | B���ۢݢޢߢ� | C���٢ڢݢ� | D��ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��ӦA2��g��+2B2��g�� 2AB2��g����H ��0������˵����ȷ��
2AB2��g����H ��0������˵����ȷ��
| A�������¶ȣ�����Ӧ�������ӣ�����Ӧ���ʼ�С |
| B�������¶������ڷ�Ӧ�������ӣ��Ӷ����̴ﵽƽ���ʱ�� |
| C���ﵽƽ��������¶Ȼ�����ѹǿ�������ڸ÷�Ӧƽ�������ƶ� |
| D���ﵽƽ������¶Ȼ��Сѹǿ�������ڸ÷�Ӧƽ�������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
t��ʱ�����������������з�����ӦX(g)+3Y(g) 2Z(g)��H<O�����Ũ�����±�
2Z(g)��H<O�����Ũ�����±�
| ���� | X | Y | Z |
| ��ʼŨ��/ mol��L-1 | 0.1 | 0.3 | 0 |
| 2minĩŨ��/mol��L-1 | 0.08 | | |
| ƽ��Ũ��/mol��L-1 | | | 0.1 |
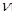 ����С��ƽ�������ƶ�
����С��ƽ�������ƶ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ��H =" +" 74.9 kJ��mol-1������˵������ȷ����
| A���÷�Ӧ���ر䡢�ʱ�Դ���0 |
| B���÷�Ӧ�����ȷ�Ӧ�����һ�������Է����� |
| C��̼���ηֽⷴӦ�������ӣ�����κ�����������̼���ηֽ�һ���Է����� |
| D�����Է����еķ�Ӧһ���Ƿ��ȷ�Ӧ�������Է����еķ�Ӧһ�������ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ͼΪij��ѧ��Ӧ����-ʱ��ͼ����t1ʱ�������¶Ȼ�����ѹǿ����������ͼ��ʾ�仯�ķ�Ӧ��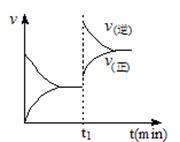
A��2SO2��g����O2��g�� 2SO3��g�� ��H��0 2SO3��g�� ��H��0 |
B��4NH3(g)��5O2(g) 4NO(g)��6H2O(g) ��H��0 4NO(g)��6H2O(g) ��H��0 |
C��H2��g����I2��g�� 2HI��g�� ��H��0 2HI��g�� ��H��0 |
D��C��s����H2O��g�� CO��g����H2��g�� ��H��0 CO��g����H2��g�� ��H��0 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com