
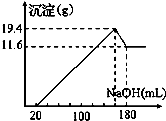
| 11.6g |
| 58g/mol |
| 1 |
| 2 |
| 4.8g |
| 24g/mol |
| 7.8g |
| 78g/mol |
| 0.7mol |
| 5mol/L |
| 0.16L×5 |
| 2 |
| 0.4mol |
| 0.05L |


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:阅读理解
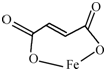 是一种可限量使用的铁强化剂
是一种可限量使用的铁强化剂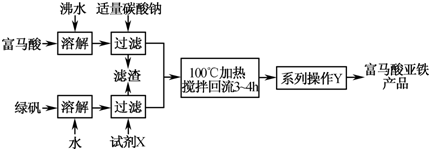
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品l.5g,加入稀硫酸25mL,用水稀释至50ml,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液. |
| ② | 取少量滤液,滴加KSCN溶液,不显红色 取少量滤液,滴加KSCN溶液,不显红色 |
| ③ | 取酸性高锰酸钾溶液适量,向其中滴加滤液至溶液褪色 取酸性高锰酸钾溶液适量,向其中滴加滤液至溶液褪色 |
| ④ | 取上述褪色后的溶液,滴加KSCN溶液显红色 取上述褪色后的溶液,滴加KSCN溶液显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |

查看答案和解析>>
科目:高中化学 来源: 题型:
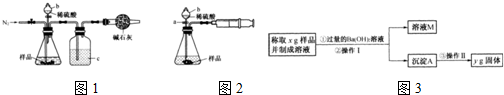
| 106y |
| 197x |
| 106y |
| 197x |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com