
已知:KClO3+NH4NO2→KCl+NH4NO3
(1)指出以上反应中的氧化剂是KClO3,被氧化的元素是N;
(2)配平上述反应方程式并标明电子转移的方向和数目 .
考点: 氧化还原反应;氧化还原反应的电子转移数目计算.
专题: 氧化还原反应专题.
分析: (1)化合价降低元素所在的反应物是氧化剂,化合价升高元素在反应中被氧化;
(2)在氧化还原反应中,化合价升高元素失去电子,化合价降低元素得到电子,得失电子相等,即为反应中转移的电子数.
解答: 解:(1)反应KClO3+NH4NO2→KCl+NH4NO3中,化合价降低的Cl元素所在的反应物KClO3是氧化剂,
化合价升高的NH4NO2中+3价的N元素在反应中被氧化,故答案为:KClO3;N;
(2)在氧化还原反应KClO3+NH4NO2→KCl+NH4NO3中,化合价升高的N元素失去2mol电子,化合价降低的Cl元素得到6mol电子,得失电子相等,即反应中转移的电子为6mol,根据电子守恒来配平方程式为:KClO3+3NH4NO2═KCl+3NH4NO3,电子转移情况为: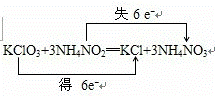 ,故答案为:
,故答案为: .
.
点评: 本题考查学生氧化还原反应中的基本概念和电子转移知识,可以根据所学知识进行回答,难度不大.


科目:高中化学 来源: 题型:
某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
①移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2﹣3滴酚酞
②用标准溶液润洗滴定管2﹣3次
③把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
④取标准KOH溶液注入碱式滴定管至0刻度以上2﹣3cm
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号填写)
(2)上述②操作的目的是
(3)实验中用左手控制 (填仪器及部位),眼睛注视 ,直至滴定终点.判断到达终点的现象是 .
下列操作,对测定结果的影响是(填“偏大”、“偏小”、“不变”)
(4)上述①操作之前,如先用蒸馏水洗锥形瓶 .
(5)滴定结束后如仰视观察滴定管中液面刻度
(6)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知水的电离平衡曲线如图所示,下列说法正确的是 ( )。
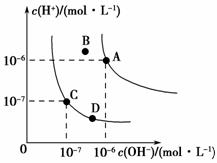
A.水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D)
B.向水中加入醋酸钠固体,可以从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7
D.升高温度可实现由C点到D点
查看答案和解析>>
科目:高中化学 来源: 题型:
下列区分Fe(OH)3悬浊液和Fe(OH)3胶体的方法中,正确的是()
A. 静置片刻出现分层现象的是Fe(OH)3胶体
B. 用放大镜观察,颗粒大小为1~100nm的是Fe(OH)3胶体
C. 用光束照射,能产生丁达尔现象的是Fe(OH)3胶体
D. 看颜色,有色的是Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
C和CuO在高温下反应可能生成Cu、Cu2O、CO2、CO.现将1g碳粉跟8g CuO混合,在硬质试管中隔绝空气高温加热,将生成的气体全部通入足量NaOH溶液中,并收集残余的气体,测得溶液增加的质量为1.1g,残余气体在标准状况下的体积为560mL.下列说法错误的是()
A. 在硬质试管中隔绝空气高温加热固体混合物时,有0.6 g碳参加了反应
B. 试管中发生的所有氧化还原反应共转移电子0.15 mol
C. 反应后试管中剩余的固体混合物的总质量为7.2 g
D. 反应生成铜和氧化亚铜的总物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
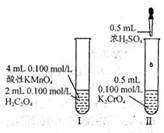
研究教材中演示实验,如右图所示,下列有关分析正确是
A.I、II中随反应进行反应速率均逐渐减小,直至为零
B.H2C2O4和H2SO4均为电解质
C.反应I和II均为氧化还原反应
D.其他条件不变,若将I反应中H2C2O4浓度改为0.2 mol·L-1,溶液褪色时间缩短,是因为增大反应物浓度,反应物中活化分子百分数提高
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)  B(g)+C(g)反应的平衡常数和温度的关系如下:
B(g)+C(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ | 700 | 800 | 900 | 1000 |
| 平衡常数 | 0.4 | 0.9 | 1.0 | 1.6 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0,△S 0(填“<”“ >”“ =”)
(2)900℃时,向一个0.5 L的密闭容器中充入6mol的A,如反应初始5s内A的平均反应速率v(A)=0.4 mol·L-1·s-1。则5s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 。保持温度和体积不变,再向容器中充入4mol的A,则重新达到平衡时A的转化率为
(3)700℃时反应C(g)+B(g) A(g)的平衡常数的值为
A(g)的平衡常数的值为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 卤代烃在NaOH存在下水解生成的有机物都是醇 |
|
| B. | 所有的一元醇都能被氧化为具有相同碳原子数的醛或酮 |
|
| C. |
|
|
| D. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。请填写下列空白:
【实验一】用如图CB31所示装置,收集一量筒甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成。
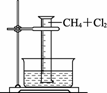
图CB31
(1)该反应的反应类型为______________。
(2)该反应的化学方程式为____________________________________________________
(只写第一步)。
(3)水槽中盛放的液体应为________(填标号)。
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
【实验二】收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(4)该实验设计的错误之处是_________________________________________________。
【实验三】步骤一:收集半试管氯气,加入10 mL蒸馏水,充分振荡,采用DIS系统的pH传感器测量溶液的pH(下同),测得pH=3.26。
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,加入10 mL蒸馏水,充分振荡,测得pH=1.00。
(5)判断该反应中有氯化氢生成的依据是________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com