
(原创)下列各组物质与其用途的关系正确的是
A.碘化钾——食盐中的加碘物质 B.二氧化硅——太阳能电池
C.福尔马林——食品保鲜剂 D.水玻璃——耐火材料
科目:高中化学 来源:2014-2015学年广东省湛江市高三普通高考测试(二)理综化学试卷(解析版) 题型:实验题
(16分)某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
(1)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
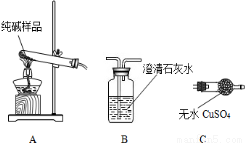
选择的装置 (填编号) | 实验现象 | 实验结论 |
样品含 NaHCO3 |
(2)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应 混和物过滤、 (填操作)、干燥、称量为m2g。该纯碱样品的纯度为 。
(3)该小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去。为探究原因,进行了下列实验:
实验1:加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
但当温度恢复到10℃,测得溶液pH=9.8。
实验2:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,澄清石灰水变浑浊。
①用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外) 、_________。这两个平衡以__________为主。
②结合实验1、2分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是________________(答一条)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市高三4月模拟考理综化学试卷(解析版) 题型:填空题
(1)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。请回答下列问题:
MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。请回答下列问题:
①写出该反应的离子反应方程式________________,
②反应中被氧化的HCl的物质的量为________mol。
③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________ molL-1。
(2)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1 molL-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
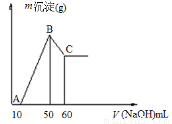
①合金中镁的质量g。
②盐酸的物质的量浓度molL-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市第三次诊断化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol Na2O2与水反应转移电子数目为0.1 NA
B.标况下,2. 24 L Cl2含孤电子对的数目为0.2NA
C.pH =2的H2SO4洛液中含H+的数目为0.1 NA
D.在l0g质量分数为17%的氨水中,含有H的数目为0.3 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期第一次月考理综化学试卷(解析版) 题型:选择题
关于10 mL 0.1 mol·L-1的NH3·H2O溶液,下列说法正确的是
A.25℃时,若溶液的pH=11,则Kb(NH3·H2O)=1×10-6
B.向溶液中加入少量CH3COONa固体,溶液中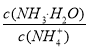 的值变小
的值变小
C.向溶液中加入10 mL 0.1 mol·L-1盐酸,所得溶液中离子浓度大小顺序为:c(NH4+)>(Cl-)>c(H+)>c(OH-)
D.向溶液中加入5 mL 0.1 mol·L-1盐酸,所得溶液中离子的浓度一定符合:c(NH4+) + c(H+) = c(Cl-) + c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
一定温度下,向2.0 L恒容密闭容器中充入1.0 mol A,经一段时间后反应A(g) B(g)+C(g)达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
B(g)+C(g)达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(B)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.前50 s内B的平均反应速率v(B)=0.0032 mol·L-1·s-1
B.相同温度下,若达到平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大
C.相同温度下,若起始时向容器中充入1.0 mol A、0.20 mol B和0.20 mol C,则达到平衡前v(正)>v(逆)
D.若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2 mol·L-1,则反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三四月考化学试卷(解析版) 题型:简答题
(14分)一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)  2N2O5(g)
2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是_________反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是_______________________________________。
(2)下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等。
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是__________。
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍 ,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照这个理论,下列微粒属于两性物质的是___________。
a.H2O
b.NO2-
c.H2NCH2COOH
d.H2PO4-
e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是___________________________________________(用离子方程式表示)。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01 mol·L-1的X、Y、Z、W溶液的pH。
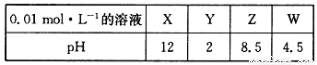
将X、Y、Z各1mol·L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 ________________________________________________。
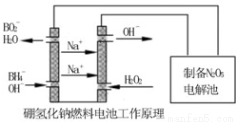
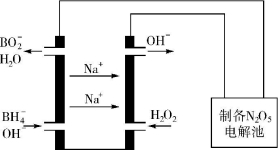 (5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为 。
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期一模理综化学试卷(解析版) 题型:选择题
据测定,指示剂酚酞的结构简式可表示为下图:,下列说法不正确的是

A.酚酞的分子式为C20H14O4
B.酚酞可与FeCl3溶液发生显色反应
C.1 mol酚酞与H2完全加成,最多可消耗10 mol H2
D.1 mol酚酞与NaOH溶液共热,最多可消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川一中高三第二次模拟考试 理综化学试卷(解析版) 题型:简答题
【化学——化学与技术】(15分)将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O  NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时转移的电子为 __ mol。
NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时转移的电子为 __ mol。
(3)海水提取镁的一段工艺流程如下图:
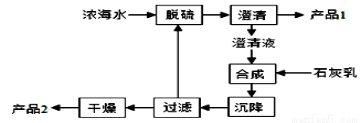
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42 - |
浓度(gL-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1 L浓海水最多可得到产品2的质量为 ______g。
(4)采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com