
| A. | 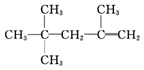 的名称为2,2,4-三甲基-4-戊烯 的名称为2,2,4-三甲基-4-戊烯 | |
| B. | 化合物 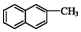 不是苯的同系物 不是苯的同系物 | |
| C. | 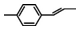 分子中所有碳原子一定共平面 分子中所有碳原子一定共平面 | |
| D. | 除甲酸外的羧酸均不能使高锰酸钾酸性溶液褪色 |
分析 A.物质为烯烃,选取含碳碳双键在内的最长碳链为主碳链,离双键近的一端编号,写出名称;
B.苯的同系物是含一个苯环,组成上相差CH2原子团的物质;
C、根据乙烯分子结构,该分子中碳原子有可能共平面,但是也有可能不共平面;
D、关键看羧酸的烃基是不是饱和,羧酸中的烃基若是含有不饱和键,就会使高锰酸钾溶液褪色.
解答 解:A、编号不正确,正确命名应为:2,4,4-三甲基-1-戊烯,故A错误;
B、同系物是指结构相似,分子间差N个CH2,该分子两个苯环相连,分子式为C10H8,都不满足同系物的要求,故B正确;
C、连接苯环和乙烯的C-C键可以旋转,故该分子可能共平面,有可能不共平面,故C错误;
D、羧酸中的烃基分为饱和和不饱和两种情况,若是不饱和,就可以和高锰酸钾反应,故D错误;
故选B.
点评 本题考查有机物的命名,同系物判断,羧酸的性质等知识,涉及知识面较多,注重基础知识考查,难度中等.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:填空题
| 时间 | 开始 | 8h后 | 16h 后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
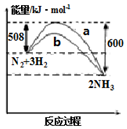
| A. | 该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=92kJ•mol-1 | |
| B. | b曲线是升高温度时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的活化能和反应热都改变 | |
| D. | 在温度体积一定的条件下,通入lmol N2和3molH2 反应后放出的热量为Q1kJ,若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ,则184>Q2>2Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X 与 Y 形成化合物时,X 可能显负价,也可能显正价 | |
| B. | 第一电离能 X 可能小于 Y | |
| C. | X 的最高价含氧酸的酸性强于 Y 的最高价含氧酸的酸性 | |
| D. | 原子序数 X 一定大于 Y |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
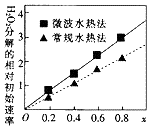 钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
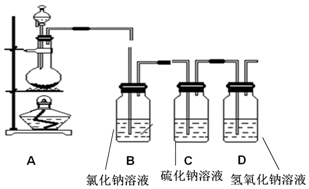
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 水电离出的c(H+)=1×10-12mol•L-1的溶液中:K+、Al3+、Cl-、SO42- | |
| C. | 加入酚酞溶液显红色的溶液中:Na+、K+、HCO3-、Cl- | |
| D. | 无色溶液中:K+、NH4+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com