
类推是化学研究中常用的一种思维方式,下列有关离子反应方程式的类推正确的是 ( )
| 已知 | 类推 | |
| A | 向次氯酸钙溶液中通CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向次氯酸钙溶液中通SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| B | 用惰性电极电解硫酸铜溶液:2Cu2++2H2O | 用铜电极电解硫酸铜溶液:2Cu2++2H2O |
| C | 稀硫酸与Ba(OH)2溶液反应,pH=7时,2H++SO | 硫酸氢钠溶液与Ba(OH)2溶液反应,pH=7时,2H++SO |
| D | Ba(OH)2溶液逐滴滴入硫酸铝钾溶液至沉淀质量达到最大值:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | Ba(OH)2溶液逐滴滴入硫酸铝铵溶液至沉淀质量达到最大值:2Ba2++4OH-+Al3++2SO42- =2BaSO4↓+AlO2- +2H2O |
科目:高中化学 来源: 题型:
在下列物质的水溶液中分别加入澄清的石灰水后,原溶液中的阴离子和阳离子都减少的是
A.FeCl2 B.CuSO4 C. Na2CO3 D.Ba(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
在碱性溶液中能大量共存且溶液为无色透明的是 ( )
A.K+、MnO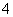 、Na+、Cl-
、Na+、Cl-
B.K+、Na+、NO 、CO
、CO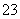
C.Na+、H+、NO 、SO
、SO
D.Fe3+、Na+、Cl-、SO
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使甲基橙变红色的溶液:Mg2+、K+、SO42- 、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3- 、NO3-
C.0. 1 mol·L-1AgNO3 溶液:H+、K+、SO42- 、I-
D.0. 1 mol·L-1NaAlO2 溶液: H+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是 ( )
A.在100 mL浓度为1 mol·L-1的 Fe(NO3)3的溶液中通入足量SO2
2Fe3++SO2+2H2O=2Fe2++SO +4H+
+4H+
B.在100 mL浓度为2 mol·L-1的FeI2的溶液中通入标准状况下5.6 L的Cl2
4Fe2++6I-+5Cl2=4Fe3++3I2+10Cl-
C.向NaHCO3溶液中加入过量的澄清石灰水
2HCO +Ca2++2OH-=CaC
+Ca2++2OH-=CaC O3↓+2H2O+CO
O3↓+2H2O+CO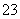
D.向明矾溶液中加入过量的氢氧化钡溶液
Al3++2SO +2Ba2++4OH-=2BaSO4↓+AlO
+2Ba2++4OH-=2BaSO4↓+AlO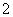 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
在pH=13的无色溶液中,可以大量共存的一组离子是 ( )
A.NH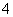 、NO
、NO 、K+、SO
、K+、SO
B.CO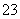 、NO
、NO 、HCO
、HCO 、Na+
、Na+
C.Na+、ClO-、AlO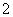 、NO
、NO
D.Cu2+、K+、Na+、SO
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,下列说法正确的是 ( )

A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应产生2 g氢气
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50.0 mL
D.该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1 mol氨基(—NH2)中含有10NA个电子
B.标准状况下,2.24 L18O2中含有2NA个中子
C.标准状况下,22.4 L C8H18中含有25NA个共价键
D.在反应CaO+3C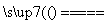 CaC2+CO↑中,每生成1 mol CO,转移3NA个电子
CaC2+CO↑中,每生成1 mol CO,转移3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理知识回答下列有关碳和碳的化合物的问题:
(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
T/℃ n/mol | NO | CO | E | F |
初始 | 0.100 | 0.100 | 0 | 0 |
T1 | 0.020 | 0.020 | 0.080 | 0.040 |
T2 | 0.010 | 0.010 | 0.090 | 0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式 .
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1= 。根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)反应生成的气体E经常用氢氧化钠来吸收,现有0.4molE,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: .
(3)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol,285.8 kJ/mol和283.0 kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式: .
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2 的混合气为正极助燃气,制得在 650 ℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极: ;正极: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com