
ЎҫМвДҝЎҝУР»ъОпMЈЁ·ЦЧУКҪЈәC6H4S4Ј©КЗТюРО·Й»ъЙПОьІЁІДБПөДЦчТӘіЙ·ЦЈ®Ді»ҜС§РЛИӨРЎЧйОӘСйЦӨЖдЧйіЙФӘЛШЈ¬ҪшРРБЛИзПВКөСйЈәҪ«ЙЩБҝСщЖ··ЕИлAөДИјЙХ№ЬЦРЈ¬НЁИлЧгБҝO2 Ј¬ УГөзВҜјУИИК№Ждід·ЦИјЙХЈ¬ІўҪ«ИјЙХІъОпТАҙОНЁИлУаПВЧ°ЦГЈ®ЈЁјРіЦТЗЖчөДЧ°ЦГТСВФИҘЈ© 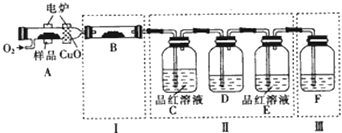
ЈЁ1Ј©РҙіцAЦРСщЖ·ИјЙХөД»ҜС§·ҪіМКҪЈә Ј®
ЈЁ2Ј©Ч°ЦГBөДДҝөДКЗСйЦӨУР»ъОпЦРә¬ЗвФӘЛШЈ¬ФтBЦРКўЧ°өДКФјБОӘ Ј®
ЈЁ3Ј©DЦРКў·ЕөДКФјБКЗЈЁМоЧЦДёЈ©Ј® aЈ®NaOHИЬТә bЈ®Ж·әмИЬТә cЈ®KMnO4ИЬТә dЈ®ұҘәНКҜ»ТЛ®
ЈЁ4Ј©ДЬЦӨГчУР»ъОпә¬МјФӘЛШөДПЦПуКЗ Ј®
ЈЁ5Ј©ИјЙХ№ЬЦР·ЕИлCuOөДЧчУГКЗ Ј®
ЈЁ6Ј©ЗлЦёіцЧ°ЦГFЦРөДҙнОуЈә Ј®
Ўҫҙр°ёЎҝ
ЈЁ1Ј©C6H4S4+11O2 ![]() 6CO2+2H2O+4SO2
6CO2+2H2O+4SO2
ЈЁ2Ј©ОЮЛ®БтЛбНӯ
ЈЁ3Ј©c
ЈЁ4Ј©EЦРЖ·әмІ»НКЙ«Ј¬FЦРУР°ЧЙ«іБөнЙъіЙ
ЈЁ5Ј©Ҫ«УР»ъОпЦРөДМјФӘЛШИ«ІҝСх»ҜіЙ¶юСх»ҜМј
ЈЁ6Ј©Г»УРЕЕЖш№ЬЈ¬»бК№ИЭЖчДЪЖшС№ұдҙуФміЙОЈПХ
ЎҫҪвОцЎҝҪвЈәЈЁ1Ј©AСщЖ·ИјЙХЈ¬HЎўCЎўSФӘЛШөДИјЙХІъОп·ЦұрКЗЛ®Ўў¶юСх»ҜМјТФј°¶юСх»ҜБтЈ¬»ҜС§·ҪіМКҪОӘЈәC6H4S4+11O2 ![]() 6CO2+2H2O+4SO2 Ј¬ ЛщТФҙр°ёКЗЈәC6H4S4+11O2
6CO2+2H2O+4SO2 Ј¬ ЛщТФҙр°ёКЗЈәC6H4S4+11O2 ![]() 6CO2+2H2O+4SO2Ј»ЈЁ2Ј©СйЦӨУР»ъОпЦРә¬ЗвФӘЛШЈ¬ҝЙТФёщҫЭЗвФӘЛШИјЙХІъОпКЗЛ®АҙјмСйЛ®өДҙжФЪЈ¬ФтBЦРКўЧ°өДКФјБҝЙОӘОЮЛ®БтЛбНӯЈ¬ЛщТФҙр°ёКЗЈәОЮЛ®БтЛбНӯЈ»ЈЁ3Ј©¶юСх»ҜБтәН¶юСх»ҜМј¶јДЬК№КҜ»ТЛ®ұд»лЧЗЈ¬јмСй¶юСх»ҜМјЦ®З°ПИјмСй¶юСх»ҜБтЈ¬УГЖ·әмјмСйјҙҝЙЈ¬Ҫ«¶юСх»ҜБтіэҫ»әуФЩјмСй¶юСх»ҜМјЈ¬DЧ°ЦГОьКХ¶юСх»ҜБтЈ¬EЦРЖ·әмјмСй¶юСх»ҜБтКЗ·сіэҫЎЈ¬FЧ°ЦГКў·ЕКҜ»ТЛ®јмСй¶юСх»ҜМјЈ¬УЙУЪЗвСх»ҜДЖИЬТәҝЙТФОьКХ¶юСх»ҜМјЈ¬№КDЦРКў·ЕЛбРФёЯГМЛбјШИЬТәЈ¬Сх»Ҝ¶юСх»ҜБт¶шіэИҘЈ¬ЛщТФҙр°ёКЗЈәcЈ»ЈЁ4Ј©УЙЈЁ3Ј©ЦР·ЦОцҝЙЦӘЈ¬EЦРЖ·әмІ»НКЙ«Ј¬FЦРУР°ЧЙ«іБөнЙъіЙЈ¬ЦӨГчУР»ъОпә¬МјФӘЛШЈ¬ЛщТФҙр°ёКЗЈәEЦРЖ·әмІ»НКЙ«Ј¬FЦРУР°ЧЙ«іБөнЙъіЙЈ»ЈЁ5Ј©Сх»ҜНӯҝЙТФҪ«МјФӘЛШІ»НкИ«ИјЙХЙъіЙөДCOЧӘ»ҜіЙCO2 Ј¬ ЛщТФҙр°ёКЗЈәҪ«УР»ъОпЦРөДМјФӘЛШИ«ІҝСх»ҜіЙ¶юСх»ҜМјЈ»ЈЁ6Ј©Ч°ЦГFГ»УРЕЕЖш№ЬЈ¬»бК№ИЭЖчДЪЖшС№ұдҙуФміЙОЈПХЈ¬ЛщТФҙр°ёКЗЈәГ»УРЕЕЖш№ЬЈ¬»бК№ИЭЖчДЪЖшС№ұдҙуФміЙОЈПХЈ®
6CO2+2H2O+4SO2Ј»ЈЁ2Ј©СйЦӨУР»ъОпЦРә¬ЗвФӘЛШЈ¬ҝЙТФёщҫЭЗвФӘЛШИјЙХІъОпКЗЛ®АҙјмСйЛ®өДҙжФЪЈ¬ФтBЦРКўЧ°өДКФјБҝЙОӘОЮЛ®БтЛбНӯЈ¬ЛщТФҙр°ёКЗЈәОЮЛ®БтЛбНӯЈ»ЈЁ3Ј©¶юСх»ҜБтәН¶юСх»ҜМј¶јДЬК№КҜ»ТЛ®ұд»лЧЗЈ¬јмСй¶юСх»ҜМјЦ®З°ПИјмСй¶юСх»ҜБтЈ¬УГЖ·әмјмСйјҙҝЙЈ¬Ҫ«¶юСх»ҜБтіэҫ»әуФЩјмСй¶юСх»ҜМјЈ¬DЧ°ЦГОьКХ¶юСх»ҜБтЈ¬EЦРЖ·әмјмСй¶юСх»ҜБтКЗ·сіэҫЎЈ¬FЧ°ЦГКў·ЕКҜ»ТЛ®јмСй¶юСх»ҜМјЈ¬УЙУЪЗвСх»ҜДЖИЬТәҝЙТФОьКХ¶юСх»ҜМјЈ¬№КDЦРКў·ЕЛбРФёЯГМЛбјШИЬТәЈ¬Сх»Ҝ¶юСх»ҜБт¶шіэИҘЈ¬ЛщТФҙр°ёКЗЈәcЈ»ЈЁ4Ј©УЙЈЁ3Ј©ЦР·ЦОцҝЙЦӘЈ¬EЦРЖ·әмІ»НКЙ«Ј¬FЦРУР°ЧЙ«іБөнЙъіЙЈ¬ЦӨГчУР»ъОпә¬МјФӘЛШЈ¬ЛщТФҙр°ёКЗЈәEЦРЖ·әмІ»НКЙ«Ј¬FЦРУР°ЧЙ«іБөнЙъіЙЈ»ЈЁ5Ј©Сх»ҜНӯҝЙТФҪ«МјФӘЛШІ»НкИ«ИјЙХЙъіЙөДCOЧӘ»ҜіЙCO2 Ј¬ ЛщТФҙр°ёКЗЈәҪ«УР»ъОпЦРөДМјФӘЛШИ«ІҝСх»ҜіЙ¶юСх»ҜМјЈ»ЈЁ6Ј©Ч°ЦГFГ»УРЕЕЖш№ЬЈ¬»бК№ИЭЖчДЪЖшС№ұдҙуФміЙОЈПХЈ¬ЛщТФҙр°ёКЗЈәГ»УРЕЕЖш№ЬЈ¬»бК№ИЭЖчДЪЖшС№ұдҙуФміЙОЈПХЈ®



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРёчНјЛщКҫөДКөСйФӯАнЎў·Ҫ·ЁЎўЧ°ЦГ»тІЩЧчХэИ·өДКЗЈЁ Ј© 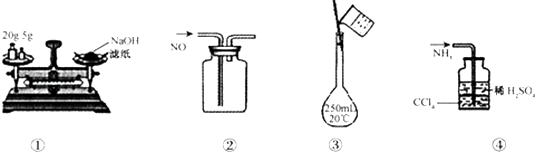
A.ўЩіЖБҝЗвСх»ҜДЖ№ММе
B.ўЪКХјҜNOЖшМе
C.ўЫЕдЦЖ100 mL 0.10 molL©Ғ1СОЛб
D.ўЬОьКХNH3І»»бФміЙө№Оь
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРЛө·ЁХэИ·өДКЗ
A. Иф°СH2S·ЦЧУРҙіЙH3S·ЦЧУЈ¬ОҘұіБЛ№ІјЫјьөДұҘәНРФ
B. H3O+АлЧУөДҙжФЪЈ¬ЛөГч№ІјЫјьІ»УҰУРұҘәНРФ
C. ЛщУР№ІјЫјь¶јУР·ҪПтРФ
D. БҪёцФӯЧУ№мөА·ўЙъЦШөюәуЈ¬БҪәЛјдөДөзЧУҪцҙжФЪУЪБҪәЛЦ®јд
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБР·ЦАл»тМбҙҝУР»ъОпөД·Ҫ·ЁХэИ·өДКЗ
СЎПо | ҙэМбҙҝОпЦК | ФУЦК | іэФУКФјБј°ЦчТӘІЩЧч·Ҫ·Ё |
A | ұҪ | деөҘЦК | јУСЗБтЛбДЖИЬТәПҙөУЈ¬·ЦТә |
B | өн·Ы | ЖПМСМЗ | Л®Ј¬№эВЛ |
C | јЧНй | ТТП© | НЁИлЛбРФёЯГМЛбјШИЬТәЈ¬ПҙЖш |
D | ТТЛбТТхҘ | ТТЛб | јУИлЗвСх»ҜДЖИЬТәЈ¬·ЦТә |
A.AB.BC.CD.D
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРЖшМеЦРјИҝЙУГЕЁБтЛбёЙФпЈ¬УЦҝЙУГ№ММеЗвСх»ҜДЖёЙФпөДКЗ(ЎЎЎЎ)
A. Cl2B. O2
C. SO2D. NH3
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРТұБ¶ҪрКфөДФӯАнХэИ·өДКЗЈЁ Ј©
A. өзҪвКіСОЛ®ЦЖұёҪрКфДЖ B. јУИИ·ЦҪвCu2OЦЖұёҪрКфНӯ
C. УГA12O3УлCOИИ»№Фӯ·ЁЦЖұёөҘЦКВБ D. КӘ·ЁБ¶НӯКЗУГМъәНБтЛбНӯИЬТә·ҙУҰ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝМюA·ЦЧУөДБўМеҪб№№ИзНјЈЁЖдЦРCЎўHФӯЧУТСВФИҘЈ©Ј»ТтЖд·ЦЧУЦРМјФӯЧУЕЕБРАаЛЖҪрёХКҜ№КГыЎ°ҪрёХНйЎұЈ¬№ШУЪҪрёХНй·ЦЧУөДЛө·ЁЦРҙнОуөДКЗЈЁ Ј© 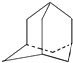
A.·ЦЧУЦРУР4ёц ![]() Ҫб№№
Ҫб№№
B.·ЦЧУЦРУР4ёцУЙБщёцМјФӯЧУ№№іЙөДМј»·
C.ҪрёХНй·ЦЧУКҪКЗC10H16
D.ҪрёХНй·ЦЧУөДТ»ВИҙъОпУР4ЦЦ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
A.5.6 gМъ·ЫУлПхЛб·ҙУҰК§ИҘөзЧУКэТ»¶ЁОӘ0.3ЎБ6.02ЎБ1023
B.·ҙУҰMgCl2ЈЁsЈ©ЁTMgЈЁsЈ©+Cl2ЈЁgЈ©өДЎчHЈј0ЎўЎчSЈҫ0
C.KspІ»ҪцУлДСИЬөзҪвЦКөДРФЦКәНОВ¶ИУР№ШЈ¬»№УлИЬТәЦРПа№ШАлЧУөДЕЁ¶ИУР№Ш
D.0.1 mol?L©Ғ1 Na2SO3ИЬТәЦРЈәcЈЁOH©ҒЈ©©ҒcЈЁH+Ј©=2cЈЁH2SO3Ј©+cЈЁHS ![]() Ј©
Ј©
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝІ»Н¬ФӘЛШөДФӯЧУөзёәРФІ»Н¬Ј¬ИфУГxЦөАҙұнКҫЈ¬xЦөФҪҙуЈ¬ЖдФӯЧУөДөзёәРФҫНФҪҙуЈ¬ОьТэөзЧУөДДЬБҰФҪЗҝЈ¬ФЪЛщРОіЙөД·ЦЧУЦРіЙОӘҙшёәөзәЙөДТ»·ҪЈ¬ПВГжКЗДіР©¶МЦЬЖЪФӘЛШөДөзёәРФөДЦөЈә
ўсA | ўтA | ўуA | ўфA | ўхA | ўцA | ўчA | |
өЪ¶юЦЬЖЪ | Li | Be | B | C | N | O | F |
өзёәРФЦө | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | |
өЪИэЦЬЖЪ | Na | Mg | Al | Si | P | S | Cl |
өзёәРФЦө | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
ЈЁ1Ј©НЁ№э·ЦОцxЦөөДұд»Ҝ№жВЙЈ¬И·¶ЁNЎўMgөДxЦөөД·¶О§ЈәЈјxЈЁMgЈ©Јј Ј¬ ЈјxЈЁNЈ©Јј Ј®
ЈЁ2Ј©НЖІвxЦөУлФӯЧУ°лҫ¶өД№ШПөКЗ Ј® ёщҫЭ¶МЦЬЖЪФӘЛШxЦөұд»ҜМШөгЈ¬МеПЦБЛФӘЛШРФЦКөДұд»Ҝ№жВЙЈ®
ЈЁ3Ј©ДіУР»ъОпҪб№№јтКҪИзНјЈ¬ЖдЦРC©ҒNЦРЈ¬ДгИПОӘ№ІУГөзЧУ¶ФЖ«ПтФӯЧУЈЁМоФӯЧУГыіЖЈ©Ј® 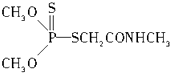
ЈЁ4Ј©ҫӯСй№жВЙёжЛЯОТГЗЈ¬өұіЙјьөДБҪФӯЧУөДxІоЦөЈ¬јҙЎчxЈҫ1.7КұЈ¬Т»°гОӘАлЧУјьЈ¬өұЎчxЈј1.7КұЈ¬Т»°гОӘ№ІјЫјьЈ®КФНЖ¶ПAlBr3ЦР»ҜС§јьөДАаРНОӘ
ЈЁ5Ј©ФӨІвФӘЛШЦЬЖЪұнЦРxЦөЧоРЎөДФӘЛШКЗЈЁМоФӘЛШ·ыәЕЈ¬·ЕЙдРФФӘЛШіэНвЈ©Ј®
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com