
【题目】海水是巨大的资源宝库,从海水中提取I2的流程如图:
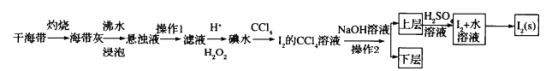
请回答下列问题:
(1)灼烧的目的是______。
(2)操作1的名称为_______
(3)滤液中加入H+、H2O2后发生反应的离子方程式为_________
(4)操作2所使用的玻璃仪器为______
(5)若加入NaOH溶液后生成的氧化产物与还原产物的物质的量之比为1:5,则该反应的化学方程式为________
【答案】除去海带中的有机物 过滤 2I-+H2O2+2H+=I2 +2H2O 分液漏斗、烧杯 6NaOH+3I2=5NaI十NaIO3 +3H2O
【解析】
干海带灼烧,将碘元素转变成可溶水的碘化钾,海带灰浸泡后过滤得到碘化钾溶液,滤液中加酸酸化后加过氧化氢将碘离子氧化成碘单质,得到碘水溶液,然后加四氯化碳萃取得含碘单质的四氯化碳溶液,分液后再含碘四氯化碳中加氢氧化钠,将碘单质转变成盐类,分液,在水溶液中加硫酸,含碘盐类重新反应得到碘单质,含碘水溶液蒸馏得到碘单质,据此分析解答。
(1)灼烧时可将海带中的有机物转变成气体除去,故答案为:除去海带中的有机物;
(2)由以上分析,操作1为过滤,故答案为:过滤;
(3)滤液中加入H+、H2O2后碘离子被氧化成碘单质,发生反应:2I-+H2O2+2H+=I2 +2H2O,故答案为:2I-+H2O2+2H+=I2 +2H2O;
(4)操作2为分液,应在分液漏斗中进行,分液时分离液体用烧杯盛接,故答案为:分液漏斗、烧杯;
(5)加入NaOH溶液后碘单质与氢氧化钠发生歧化反应,若生成的氧化产物与还原产物的物质的量之比为1:5,根据价态可知还原产物只能是碘化钠,若生成5molNaI转移电子数为5mol,则产生1mol氧化产物也转移5mol电子,氧化产物应为碘酸钠,反应为:6NaOH+3I2=5NaI十NaIO3 +3H2O,
故答案为:6NaOH+3I2=5NaI十NaIO3 +3H2O;


科目:高中化学 来源: 题型:
【题目】现有部分元素的原子结构特点如表,下列叙述中正确的是( )
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 共用三对电子形成双原子分子,常温下为气体单质 |
A.W原子结构示意图为![]()
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
D.X、Y、Z、W四种元素不能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
④H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ 热量
C.氢气的燃烧热为241.8kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.工业上用熔融的金属钠制取金属钾:KCl(l)+Na(l)![]() NaCl(l)+K(g)
NaCl(l)+K(g)
B.对于反应2HI(g)![]() H2(g)+I2 (g),达到平衡后缩小容器体积可使体系颜色变深
H2(g)+I2 (g),达到平衡后缩小容器体积可使体系颜色变深
C.氨水中加入NaOH固体有利于氨气的溢出
D.实验室用排饱和食盐水的方法来收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO![]() 移向________极(填“正”或“负”),已知CH4发生反应的电极反应式为_____________________________,则另一极的电极反应式为___________________________ 。
移向________极(填“正”或“负”),已知CH4发生反应的电极反应式为_____________________________,则另一极的电极反应式为___________________________ 。
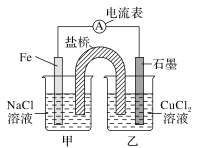
(2)某实验小组同学对电化学原理进行了一系列探究活动。
1)如图为某实验小组设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
2)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,
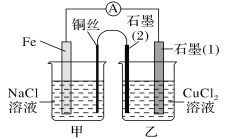
一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是________________,电极反应为________________________;乙装置中石墨(1)为________极(填“正”“负”“阴”或“阳”),乙装置中与铜丝相连石墨(2)电极上发生的反应式为________________,产物常用________检验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+ CO2(g)=2CO(g)+2H2(g) △H=+247kJ/mol;
①有利于提高CH4平衡转化率的条件是____
A. 高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应CH4(g)= C(s)+2H2(g) | 消碳反应CO2(g)+ C(s)= 2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/(kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________
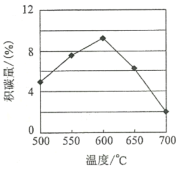
A.K积、K消均增加
B.v积减小,v消增加
C.K积减小,K消增加
D.v消增加的倍数比v积增加的倍数‘
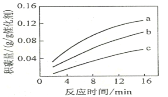
②在一定温度下,测得某催化剂上沉积碳的生成速率方v=k·p(CH4)·![]() (k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)氨气分解反应的热化学方程式如下:2NH3(g)![]() N2(g)+3H2(g) △H。若:N
N2(g)+3H2(g) △H。若:N![]() N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJmol-1)则上述反应的△H=______________(用含a、b、c的代数式表示)kJmol-1。
N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJmol-1)则上述反应的△H=______________(用含a、b、c的代数式表示)kJmol-1。
(2)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位:mmolmin-1)与催化剂的对应关系如表所示。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是______________(填写催化剂的化学式)。
②温度为T时,在恒容的密闭容器中加入2molNH3,此时压强为po,用Ru催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数Kp=______________。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
N2(g)+3H2(g)的化学平衡常数Kp=______________。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
(3)关于合成氨工艺的理解,下列说法不正确的是______________(填字母)。
A.合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率
C.合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高
(4)在1L1molL-1盐酸中缓缓通入2mol氨气,请在图1中画出溶液中水电离出的OH一浓度随通入氨气的物质的量变化的趋势图。_____________
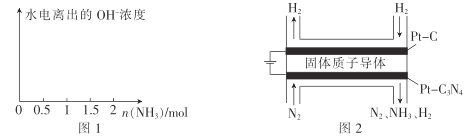
(5)电化学法合成氨:图2是用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3的原理示意图。
①Pt—C3N4电极上产生NH3的电极反应式为______________ 。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有Na2SO4、NaHCO3的NaCl固体提纯,制得纯净的氯化钠溶液,某学习小组设计了如下图所示的实验方案:
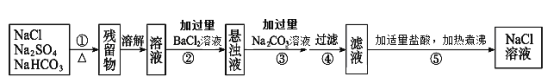
回答下列问题:
(1)操作①加热过程中,发生反应的化学方程式是_______。
(2)操作②不用Ba(NO3)2溶液的理由是:__________。
(3)进行操作②中,判断“BaCl2溶液是否过量”的方法是:_________。
(4)操作③“加入过量Na2CO3溶液”的目的是:________。
(5)操作⑤中“加适量盐酸”的主要目的是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com