
下列反应中,反应后固体物质增重的是( )
A.氨气通过灼热的CuO粉末 B. 将锌粒投入Cu(NO3)2溶液
C.铝与Fe2O3发生铝热反应 D.水蒸气通过Na2O2粉末
【知识点】钠的重要化合物;镁、铝的重要化合物;铜金属及其重要化合物的主要性质 C2
【答案解析】D 解析:A.发生氢气与CuO的反应生成Cu和水,反应前固体为CuO,反应后固体为Cu,固体质量减小,故A错误;B.发生Zn与Cu(NO3)2反应生成Zn(NO3)2和Cu,反应前固体为Zn,反应后固体为Cu,二者物质的量相同,则固体质量减小,故B错误; C.发生Al与Fe2O3反应生成Al2O3和Fe,反应前固体为氧化铁、Al,反应后固体为氧化铝、Fe,均为固体,固体质量不变,故C错误;D.发生水蒸气与过氧化钠的反应生成氢氧化钠和氧气,反应前固体为过氧化钠,反应后固体为氢氧化钠,二者物质的量不同,氢氧化钠的物质的量是过氧化钠的2倍,故固体质量增加,故D正确。
【思路点拨】本题考查了元素化合物性质,把握发生的化学反应及反应前后固体的分析为解答的关键,注意反应中物质的质量变化,题目难度不大。


科目:高中化学 来源: 题型:
工业上从废铅蓄电池的铅膏回收铅的过程中,可用碳酸盐溶液与处理后的铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq) PbCO3(s)+SO42-(aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
PbCO3(s)+SO42-(aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(1)上述反应的平衡常数表达式:K=
(2)室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化。在 溶液中PbSO4转化率较大,理由是
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],它和PbCO3受热都易分解生成PbO。该课题组对固体产物(不考虑PbSO4)的成分提出如下假设。请你完成假设二和假设三:
假设一:全部为PbCO3;
假设二: ;
假设三: 。
(4)为验证假设一是否成立,课题组进行如下研究:
①定性研究:请你完成下表中内容
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥, |
②定量研究:取26.7 mg的干燥样品,加热,测
得固体质量随温度的变化关系如下图。某同学
由图中信息得出结论:假设一不成立。你是否
同意该同学的结论,并简述理由:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.铁管上镶嵌锌块,铁管不易被腐蚀
D.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,生成沉淀的质量之比为________。
(2)向等体积、等浓度的AgNO3溶液中,分别加入相同体积的NaCl、MgCl2、AlCl3溶液,恰好使它们中的Cl-完全转化为AgCl沉淀,则三种溶液的物质的量浓度之比为________。
(3)Na、Mg、Al分别与足量的硫酸溶液反应,当生成气体的质量相同时,消耗Na、Mg、Al的物质的量之比为________。
(4)足量的Al分别与等浓度的硫酸、氢氧化钠溶液反应,当生成气体的质量相同时,硫酸溶液和氢氧化钠溶液的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
.下列各组物质,不能按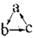 (“
(“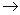 ”表示反应一步完成)关系转化的是
”表示反应一步完成)关系转化的是
| 选项 | a | b | c |
| A | Al2O3 | NaAlO2 | Al(OH)3 |
| B | AlCl3 | Al(OH)3 | NaAlO2 |
| C | Al | Al(OH)3 | Al2O3 |
| D | MgCl2 | Mg(OH)2 | MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:
.在离子浓度都为0.1 mol/L下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确是
A.在含Fe3+、 Cu2+、 H+的溶液中加入锌粉:Cu 2+、 Fe3+、H+
B.在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32-
C.在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO3-
D.在含Fe 3+、 H+、NH4+ 的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如右图所示。W元素的简单离子半径在同周期元素的简单离子中最小。下列说法中正确的是( )

A.原子半径由小到大的顺序为:Y < X < W < Z
B.X元素最高价氧化物分子的比例模型为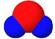
C.Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性
D.W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备。
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 ( )
A.4 mol·L-1 HNO3 B.3 mol·L-1 HCl C.8 mol·L-1 NaOH D.18 mol·L-1 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.据有关资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。根据上述信息,完成下面两题:
(1)下列关于天然气水合物中两种分子描述正确的是
A.两种都是极性分子 B.两种都是非极性分子
C.H2O是极性分子,CH4是非极性分子 D.其中氧原子和碳原子的杂化方式均为sp3
E.其中氧原子和碳原子的杂化方式分别为sp2和sp3
(2)晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为
II.(1)兰聚氰胺分子的结构简式如图所示,则其中氮原子轨道杂化类型是 ,l mol三聚氰胺分子中含 mol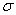 键。
键。
(2)某元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的M层电子排布式为____ 。
 (3)过渡金属配合物Ni( CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=____ 。
(3)过渡金属配合物Ni( CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=____ 。
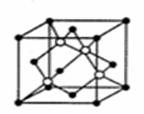
(4)碳化硅的晶胞结构(如右图)与金刚石类
似(其中“●”为碳原子,“○”为硅原子)。
图中“●”点构成的堆积方式与下列图式
中 所表示的堆积方式相同。

(5)碳化硅的结构中,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为 (用含a、b、c的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com