
| A.制饭勺、饭盒、高压锅等的不锈钢是合金 |
| B.做衣服的棉和麻均与淀粉互为同分异构体 |
| C.煎炸食物的花生油和牛油都是可皂化的饱和酯类 |
| D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.Fe2O3 | B.Fe3O4 | C.Fe4O5 | D.Fe5O7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
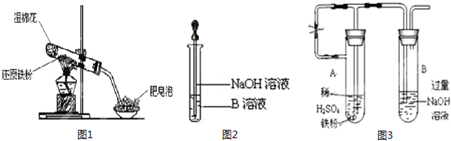
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2240mL | B.3360mL | C.3675mL | D.4480mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
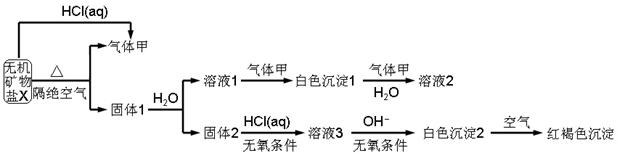
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
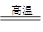 2Cu + SO2
2Cu + SO2 FeSO4 + Cu
FeSO4 + Cu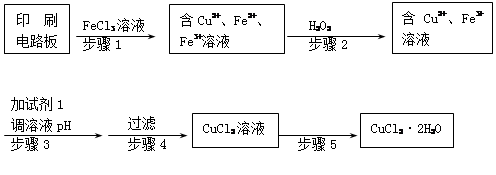
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com