
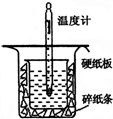
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:分析 (1)根据量热计的构造来判断该装置的缺少仪器;为了减少热量的损失,大烧杯杯口与小烧杯杯口相平;
(2)根据混合液总体积判断烧杯的规格;
(3)根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热.
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;为了减少热量的损失,大烧杯杯口与小烧杯杯口相平,图示装置中小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高),
故答案为:环形玻璃搅拌棒;小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高);
(2)氢氧化钠溶液和盐酸溶液的总体积为100mL,则小烧杯的规格应该为100mL,
故答案为:②;
(3)50mL0.50mol/L氢氧化钠与50mL0.55mol/L盐酸溶液进行中和反应,生成水的物质的量为:0.05L×0.50mol/L=0.025mol,溶液的质量为:100mL×1g/cm3=100g,温度变化的值为△T=(t2-t1)℃,则生成0.025mol水放出的热量为:Q=m•c•△T=100g×4.18J/(g•℃)×(t2-t1)℃=418(t2-t1)J,
所以实验测得的中和热△H=-$\frac{0.418({t}_{2}-{t}_{1})kJ}{0.025mol}$=-$\frac{0.418({t}_{2}{-t}_{1})}{0.025}$kJ/mol,
故答案为:-$\frac{0.418({t}_{2}{-t}_{1})}{0.025}$kJ/mol.
点评 本题考查了中和热的测定,题目难度中等,注意理解中和热的概念及测定反应热的方法,明确中和热的计算方法,试题培养了学生的化学计算和化学计算能力.


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧乙酸不能使品红褪色 | |
| B. | 过氧乙酸可与苯酚混合使用 | |
| C. | 过氧乙酸分子中只含有极性键 | |
| D. | 过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常用电解法制备元素C、D、E的单质 | |
| B. | 元素A、B组成的化合物常温下一定呈气态 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 元素C、D的最高价氧化物对应的水化物之间肯定不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| A | H2、O2 | N2、CuO |
| B | HCl、NaOH | Fe、Al |
| C | SiO2、浓H2SO4 | NaOH、C |
| D | CO2、H2O | Na2O2、NaCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 温度为78℃时固体物质M的化学式为FeSO4•5H2O | |
| B. | 取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4 | |
| C. | 在隔绝空气条件下,N得到P的化学方程式为FeSO4•H2O $\frac{\underline{\;高温\;}}{\;}$FeSO4+H2O | |
| D. | 温度为l59℃时固体N的化学式为FeSO4•2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol 12C原子的质量是12g,1个12C原子的质量是$\frac{12}{{N}_{A}}$g | |
| B. | 在常温常压下,11.2LN2含有分子数为0.5NA | |
| C. | 18g水所含有的氢原子数目为2NA,氧原子数目为NA | |
| D. | 1L 0.1mol•L-1K2SO4溶液中,K+ 和SO42-的离子总数是0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com