

| m |
| M |
| 1.16g |
| 58g/mol |
| n(HCl) |
| c(HCl) |
| 0.13mol |
| 1mol/L |


科目:高中化学 来源: 题型:

| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 8.3 | 9.6 |
| 沉淀完成 | 3.7 | 9.6 | 9.8 | 11.1 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
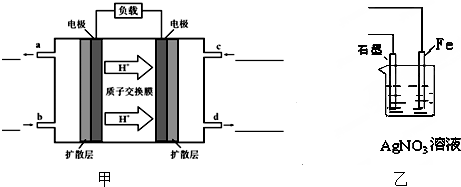
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海水中金、锶、碳、铜、铁等元素属于微量元素 |
| B、海底多数金属结合矿含有铁、锰、钴等多种金属元素 |
| C、通过蒸馏法、电渗析法、离子交换法等可以实现海水的淡化 |
| D、海水提溴过程溴元素依次发生氧化反应、还原反应、氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动了 |
| B、物质A的转化率减小了 |
| C、物质B的质量分数增加了 |
| D、a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气态氢化物稳定性:HmW>HnR |
| B、Y和Z形成的某种化合物中含离子键、非极性健 |
| C、Y、Z、R三者形成的某种化合物溶于水后,可形成碱性溶液 |
| D、标准状况下,1mol XW4的体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com