
分析 (1)①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2 220kJ•mol-1
②H2O(l)═H2O(g)△H=44.0kJ•mol-1,
结合盖斯定律可知,①+②×4得到C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);
(2)①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol-1;
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ•mol-1
结合盖斯定律可知,①×2-②得到CH4(g)+2H2O(g)=CO2(g)+4H2(g),以此来解答.
解答 解:(1)①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2 220kJ•mol-1
②H2O(l)═H2O(g)△H=44.0kJ•mol-1,
结合盖斯定律可知,①+②×4得到C3H8(g)+5O2(g)=3CO2(g)+4H2O(g),△H=(-2 220kJ•mol-1)+(44.0kJ•mol-1)×4=-2044kJ•mol-1,
则丙烷燃烧生成CO2和气态水的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(g)△H=-2044kJ•mol-1,
故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(g)△H=-2044kJ•mol-1;
(2)①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol-1;
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ•mol-1
结合盖斯定律可知,①×2-②得到CH4(g)+2H2O(g)=CO2(g)+4H2(g),△H=(+206.2kJ•mol-1)×2-(+247.4kJ•mol-1)=+165 kJ•mol-1,
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165 kJ•mol-1,
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165 kJ•mol-1.
点评 本题考查热化学方程式,为高频考点,把握反应中能量变化、焓变的计算为解答关键,侧重分析与应用能力的考查,注意盖斯定律的应用,题目难度不大.


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、H2SO4、HCl、NaNO3 | B. | NaOH、NaCl、K2SO4、FeCl3 | ||
| C. | HCl、AgNO3、HNO3、MgCl2 | D. | K2SO4、Na2CO3、BaCl2、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NaOH溶液中Na+的数目为0.1 NA | |
| B. | 标准状况下,2.24 L CCl4中的分子数目为0.1 NA | |
| C. | 0.1 mol Na2O2与足量CO2反应转移的电子数目为0.1 NA | |
| D. | 3.2 g O2和O3的混合物含有的分子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
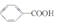 )和石灰的混合物得到一种液体,命名为苯.写出苯甲酸钠(
)和石灰的混合物得到一种液体,命名为苯.写出苯甲酸钠(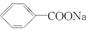 )与NaOH、生石灰共热生成苯的化学方程式:
)与NaOH、生石灰共热生成苯的化学方程式: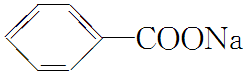 +NaOH
+NaOH  +Na2CO3.
+Na2CO3. 来制取
来制取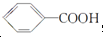 需要的试剂是KMnO4酸性溶液,下列物质属于苯的同系物且能被该试剂氧化的是d.
需要的试剂是KMnO4酸性溶液,下列物质属于苯的同系物且能被该试剂氧化的是d.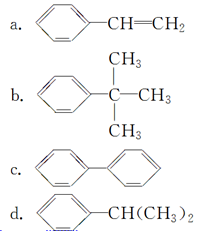
 .
.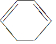 )脱去2mol氢原子变成苯却要放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).
)脱去2mol氢原子变成苯却要放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”). .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
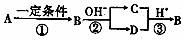 化合物A、B、C、D中均含有短周期元素X,B是一种常见的单质,它们有如图5所示的转化关系(部分产物与反应条件已略去),下列说法正确的是
化合物A、B、C、D中均含有短周期元素X,B是一种常见的单质,它们有如图5所示的转化关系(部分产物与反应条件已略去),下列说法正确的是| A. | X元素可能是金属,也可能是非金属 | |
| B. | 反应①、②、③均为氧化还原反应 | |
| C. | 反应②、③为可逆反应 | |
| D. | 若B为金属单质,反应①的“一定条件”为电解时,通常加入冰晶石作为助溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

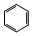 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$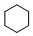
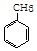 +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$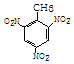 +3H2O,反应类型取代反应
+3H2O,反应类型取代反应 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com