
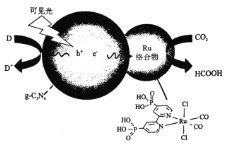
【题目】一种Ru络合物与g-C3N4复合光催化剂将CO,还原为HCOOH的原理图如图所示。
(1)基态碳原子的价电子排布图为_____________。
(2)1molHCOOH中含有的σ键数目为_____________,HCOOH的沸点比CO2高的原因为_____________。
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为_____________
(4)Ru络合物中与Ru配位的原子有N、_____________。
(5)Ru络合物含有的片段![]() 和
和![]() 中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是_____________(填“前者”或“后者”)。
中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是_____________(填“前者”或“后者”)。
(6)一种类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。

①g-C3N4中氮原子的杂化类型是_____________。
②根据图2,在图1中用平行四边形画出一个最小重复单元。_____________
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g-C3N4的密度为____g.cm-3。
【答案】![]() 4NA HCOOH和CO2均为分子晶体,但HCOOH分子间存在氢键 N>O>C Cl、C 前者 sp2杂化
4NA HCOOH和CO2均为分子晶体,但HCOOH分子间存在氢键 N>O>C Cl、C 前者 sp2杂化 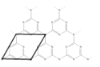
![]()
【解析】
(5)![]() 中N原子有一对孤电子,容易给出电子对形成配位键,
中N原子有一对孤电子,容易给出电子对形成配位键,![]() 中N原子参与形成大π键,不易给出电子对形成配位键。
中N原子参与形成大π键,不易给出电子对形成配位键。
(6)③由均摊法可知,该晶胞中N原子个数=8×![]() +8×
+8×![]() +2×
+2×![]() +4=8,C原子个数=3+6×
+4=8,C原子个数=3+6×![]() =6,
=6,
(1)C为6号元素,基态碳原子的价电子排布图为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)单键全是σ键,双键有一个是σ键,一个是π键,所以,1molHCOOH中含有4molσ键,即4NA,HCOOH和CO2均为分子晶体,但HCOOH分子间存在氢键,故HCOOH的沸点比CO2高,故答案为:4NA;HCOOH和CO2均为分子晶体,但HCOOH分子间存在氢键;
(3)Ru络合物中除Ru元素外还有H、C、N、O、P、Cl元素,位于第二周期的有: C、N、O三种元素,一般情况下,从左往右,第一电离能增大,但第ⅤA族的N原子2p轨道电子处于半充满状态,比O难失电子,第一电离能比O大,综上所述,三者第一电离能由大到小的顺序为:N>O>C,故答案为:N>O>C;
(4)由图可知,Ru络合物中与Ru配位的原子有N、Cl、C,故答案为:Cl、C;
(5)前者的sp2杂化轨道上有一个孤电子对,更容易形成配位键,故答案为:前者;
(6)①该物质中N原子价层电子对数为3,根据价层电子对互斥理论判断N原子杂化类型为sp2杂化,故答案为:sp2杂化;
②由图二可知,重复的结构单元为六元环和外加三个N原子形成的结构,如图所示: ,故答案为:
,故答案为: ;
;
③由均摊法可知,该晶胞中N原子个数=8×![]() +8×
+8×![]() +2×
+2×![]() +4=8,C原子个数=3+6×
+4=8,C原子个数=3+6×![]() =6,1个晶胞的质量=
=6,1个晶胞的质量=![]() ,密度ρ=
,密度ρ=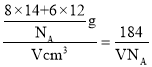 g.cm-3,故答案为:
g.cm-3,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是

A. 复分解反应、复分解反应、化合反应、置换反应
B. 中和反应、置换反应、复分解反应、置换反应
C. 复分解反应、复分解反应、置换反应、置换反应
D. 分解反应、复分解反应、置换反应、置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
A. 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA
B. 2.3g钠在空气中燃烧生成多种氧化物是转移电子数为0.1NA
C. 1.8g D2O中含有的质子数为1.0NA
D. 235g核素![]() 发生裂变反应
发生裂变反应![]() +
+ ![]()
![]()
![]() Sr+
Sr+![]() Xe+10
Xe+10![]() n,净产生的中子(
n,净产生的中子(![]() n)数为10NA
n)数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)①H3PO2是一元中强酸,写出其电离方程式______________________。
②NaH2PO2为___________(填“正盐”或“酸式盐”),其溶液显___________(填“弱酸性”“中性”或“弱碱性”)。
③H3PO2中,P元素的化合价为___________;
(2)H3PO2可用于化学镀银,反应中Ag+还原为银,H3PO2氧化为H3PO4,该反应中氧化剂与还原剂的物质的量之比为________。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4 反应,写出白磷与Ba(OH)2溶液反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
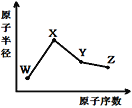
A. 化合物XZW既含离子键也含共价键
B. 对应气态氢化物的稳定性Y>Z
C. X和W两种元素形成的化合物是共价化合物
D. Y的氧化物能与Z或X的最高价氧化物对应的水化物都能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,科学家研发出一种新型质子膜电池,下列有关说法正确的是( )

A.电流方向为由电极a流向电极bB.a电极反应式:2H2S-4e- =S2+4H+
C.用此电源电解精炼铜,粗铜接在a电极D.该装置中H+由电极b经质子膜移动到电极a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(2019-nCOV)的感染,其结构如图所示。下列说法错误的是
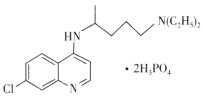
A.基态C1原子的核外电子有17种运动状态
B.C、N、O、P四种元素中电负性最大的是O
C.H3PO4分子中磷原子的价层电子对数为4
D.与足量H2发生加成反应后,该分子中手性碳原子个数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。其一种生产工艺如图所示。下列说法正确的是
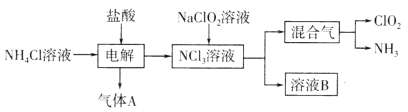
A.气体A为Cl2
B.参加反应的NaClO2和NCl3的物质的量之比为3:1
C.溶液B中含有大量的Na+、Cl-、OH-
D.可将混合气通过饱和食盐水除去C1O2中的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A.钢铁吸氧腐蚀中的正极反应:4OH 4e-=2H2O +O2↑
B.工业上用电解法制镁:MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
C.使pH试纸显蓝色的溶液中:Na+、Mg2+、ClO-、HSO3-能大量共存
D.![]() =0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-能大量共存
=0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-能大量共存
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com