

| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
分析 用异丙苯氧化法生产苯酚和丙酮,由给予的反应信息,异丙苯与氧气在反应器A中发生氧化反应生成 ,在蒸发器中分离出
,在蒸发器中分离出 ,未反应的异丙苯进行循环利用,
,未反应的异丙苯进行循环利用, 在分解釜中在浓硫酸作催化剂条件下分解得到
在分解釜中在浓硫酸作催化剂条件下分解得到 、
、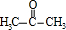 ,在中和釜中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后用水洗涤,再经过蒸馏,由于丙酮的沸点低于苯酚,则T为丙酮、P为苯酚.
,在中和釜中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后用水洗涤,再经过蒸馏,由于丙酮的沸点低于苯酚,则T为丙酮、P为苯酚.
(1)在反应器A发生信息中的反应①,应通入氧气或空气;
(2)由上述分析可知,反应①在A中发生,反应②在C中发生;
(3)浓硫酸起催化剂作用,浓硫酸腐蚀性强,会腐蚀设备;
(4)反应②的△H<0,为放热反应,含有过氧化物,温度过高,容易发生爆炸,
(5)加入的Z中和硫酸,且不能与苯酚反应;
(6)沸点越低越先蒸出,处于蒸馏塔的上部;
(7)由异丙苯最终得到苯酚和丙酮,原子利用率高.
解答 解:用异丙苯氧化法生产苯酚和丙酮,由给予的反应信息,异丙苯与氧气在反应器A中发生氧化反应生成 ,在蒸发器中分离出
,在蒸发器中分离出 ,未反应的异丙苯进行循环利用,
,未反应的异丙苯进行循环利用, 在分解釜中在浓硫酸作催化剂条件下分解得到
在分解釜中在浓硫酸作催化剂条件下分解得到 、
、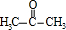 ,在中和釜中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后用水洗涤,再经过蒸馏,由于丙酮的沸点低于苯酚,则T为丙酮、P为苯酚.
,在中和釜中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后用水洗涤,再经过蒸馏,由于丙酮的沸点低于苯酚,则T为丙酮、P为苯酚.
(1)在反应器A发生信息中的反应①,故需要氧气或空气,所以X为氧气或空气,
故答案为:氧气或空气;
(2)由上述分析可知,反应①在反应器中发生,即A装置,反应②在分解釜中进行,即C装置,
故答案为:A;C;
(3) 在浓硫酸作条件下分解得到
在浓硫酸作条件下分解得到 、
、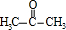 ,浓硫酸作作催化剂,浓硫酸腐蚀性强,容易腐蚀设备,
,浓硫酸作作催化剂,浓硫酸腐蚀性强,容易腐蚀设备,
故答案为:催化剂;腐蚀设备;
(4)反应②的△H<0,为放热反应,有过氧化物存在,温度过高会导致爆炸,反应温度控制在50-60℃,
故答案为:放热;温度过高会导致爆炸;
(5)加入Z的目的是中和硫酸,且不能与苯酚反应,
a.NaOH能与硫酸、苯酚反应,故不选;
b.CaCO3为固体,且与硫酸反应生成的硫酸钙微溶,会阻止碳酸钙与硫酸的反应,故b不选;
c.NaHCO3能与硫酸反应,不与苯酚反应,故c选;
d.CaO能与苯酚反应,且与硫酸反应生成的硫酸钙微溶,会阻止碳酸钙与硫酸的反应,故d不选;
故选:c;
(6)由于丙酮的沸点低于苯酚,沸点越低越先蒸出,处于蒸馏塔的上部,则T为丙酮、P为苯酚,
故答案为:丙酮;苯酚;丙酮的沸点低于苯酚;
(7)由异丙苯最终得到苯酚和丙酮,整个过程原子利用率高,
故答案为:原子利用率高.
点评 本题考查有机物的制备实验方案,涉及对化学工艺流程、装置及试剂的分析评价等,关键是根据实验目的与给予的反应信息理解工艺流程原理,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若A2和B2的总能量之和大于生成的AB的总能量,则反应吸热 | |
| B. | 若A2和B2的总能量之和小于生成的AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<2Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热183 kJ | B. | 放热183 kJ | C. | 放热91.5 kJ | D. | 吸热91.5 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O△H=-48.40 kJ/mol | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5518 kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+5518 kJ/mol | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+48.40 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 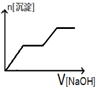 | C. | 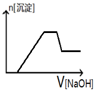 | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com