
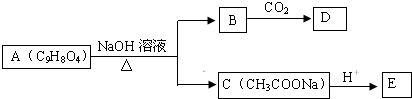
 .
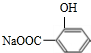
. +3NaOH$\stackrel{△}{→}$
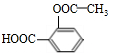
+3NaOH$\stackrel{△}{→}$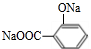 +CH3COONa+2H2O.
+CH3COONa+2H2O.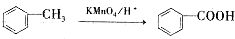 ,且苯酚和乙酸在一定条件下能发生酯化反应.请选用适当物质设计一种合成方法,用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式(其中反应①条件为CH3COOH/浓H2SO4;反应②的条件为KMnO4/H+)
,且苯酚和乙酸在一定条件下能发生酯化反应.请选用适当物质设计一种合成方法,用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式(其中反应①条件为CH3COOH/浓H2SO4;反应②的条件为KMnO4/H+)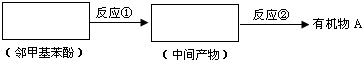
分析 A在一定条件下能与醇发生酯化反应,分子中含有-COOH,A在氢氧化钠水溶液生成C(乙酸钠),故A分子中还含有酯基,由A的分子式C9H8O4可知,A中有一个苯环,且A分子中苯环上的两个取代基连在相邻的碳原子上,则A的结构简式为 ,故B结构简式为
,故B结构简式为 ,D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应,碳酸酸性强于苯酚,但苯酚电离出氢离子能力强于碳酸氢根离子,则D中有酚羟基并无羧基,所以B溶液中通入气体CO2生成D,故D为
,D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应,碳酸酸性强于苯酚,但苯酚电离出氢离子能力强于碳酸氢根离子,则D中有酚羟基并无羧基,所以B溶液中通入气体CO2生成D,故D为 ,D酸化得到F,F为
,D酸化得到F,F为 ,C酸化得到E为CH3COOH,
,C酸化得到E为CH3COOH,
(5)邻甲基苯酚和乙酸中浓硫酸作催化剂、加热条件下发生酯化反应生成乙酸邻甲基苯酯,乙酸邻甲基苯酯被酸性高锰酸钾溶液氧化生成A.
解答 解:A在一定条件下能与醇发生酯化反应,分子中含有-COOH,A在氢氧化钠水溶液生成C(乙酸钠),故A分子中还含有酯基,由A的分子式C9H8O4可知,A中有一个苯环,且A分子中苯环上的两个取代基连在相邻的碳原子上,则A的结构简式为 ,故B结构简式为
,故B结构简式为 ,D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应,碳酸酸性强于苯酚,但苯酚电离出氢离子能力强于碳酸氢根离子,则D中有酚羟基并无羧基,所以B溶液中通入气体CO2生成D,故D为
,D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应,碳酸酸性强于苯酚,但苯酚电离出氢离子能力强于碳酸氢根离子,则D中有酚羟基并无羧基,所以B溶液中通入气体CO2生成D,故D为 ,D酸化得到F,F为
,D酸化得到F,F为 ,C酸化得到E为CH3COOH,
,C酸化得到E为CH3COOH,
(1)A转化为B、C时,涉及到的反应类型有取代反应或水解反应、中和反应,故答案为:取代反应或水解反应、中和反应;
(2)E为CH3COOH,E的两种同分异构体Q、R都能在一定条件下发生银镜反应,说明含有醛基,R能与Na反应放出H2,而Q不能,则R中含有醇羟基而Q中不含醇羟基,则Q、R的结构简式分别为HCOOCH3、HOCH2CH3,
故答案为:HCOOCH3;HOCH2CH3;
(3)D的结构简式为 ,故答案为:
,故答案为: ;
;
(4)A在加热条件下与NaOH溶液反应的化学方程式为 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+2H2O,
+CH3COONa+2H2O,
故答案为: +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+2H2O;
+CH3COONa+2H2O;
(5)邻甲基苯酚和乙酸中浓硫酸作催化剂、加热条件下发生酯化反应生成乙酸邻甲基苯酯,乙酸邻甲基苯酯被酸性高锰酸钾溶液氧化生成A,邻甲基苯酚结构简式为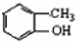 ,中间产物结构简式为
,中间产物结构简式为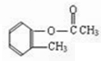 ,
,
故答案为: ;
; .
.
点评 本题考查有机推断和有机合成,为高频考点,侧重考查学生分析推断及获取信息解答问题能力,明确常见有机物结构和性质、常见反应类型及反应条件是解本题关键,关键要正确推断A结构简式,难点是有机合成路线设计,题目难度中等.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加稀硝酸,沉淀不溶解 该溶液中一定含有SO42- | |
| B. | 向某溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀生成 该溶液中一定含有SO42- | |
| C. | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 该溶液一定含有CO32- | |
| D. | 向某溶液中加入NaOH浓溶液并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体 该溶液中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:
核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
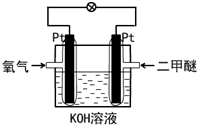
| A. | 电流流向:右边Pt电极→导线→左边Pt电极 | |
| B. | 通入氧气这边的Pt电极为负极 | |
| C. | 溶液中OH-向右边Pt电极移动 | |
| D. | 通入二甲醚的电极反应式:12OH-+CH3OCH3-12e-=2CO2+9H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.60 | 19.65 | 19.55 |
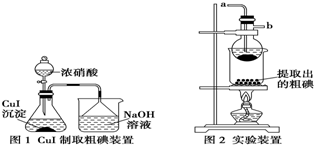
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com