
��16�֣���ҵ�ϳɰ����Ʊ�����һ��������������������£�
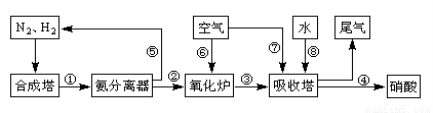
��1����ҵ����ʱ����ȡ������һ����ӦΪ��CO(g)+H2O(g) CO2(g)+H2(g)��t��ʱ����10L�ܱ������г���2mol CO��3molˮ��������Ӧ����ƽ�����ϵ��c(H2)=0.12mol��L-1������¶��´˷�Ӧ��ƽ�ⳣ��K= �������������
CO2(g)+H2(g)��t��ʱ����10L�ܱ������г���2mol CO��3molˮ��������Ӧ����ƽ�����ϵ��c(H2)=0.12mol��L-1������¶��´˷�Ӧ��ƽ�ⳣ��K= �������������
��2���ϳ����з�����ӦN2(g)+3H2(g) 2NH3(g) ��H<0���±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����ɴ˿���֪������T1 300�棨�>������<����=������
2NH3(g) ��H<0���±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����ɴ˿���֪������T1 300�棨�>������<����=������
T/�� | T1 | 300 | T2 |
K | 1.00��107 | 2.45��105 | 1.88��103 |
��3�������ڴ�����ȼ������һ�ֵ��ʺ�ˮ����ѧ�����ô�ԭ������Ƴɡ�����-������ȼ�ϵ�أ���ͨ�백���ĵ缫�� ����������������������������£��õ缫������Ӧ�ĵ缫��ӦʽΪ ��
��4���ð������������������ᣬ��β���е�NOx����Ⱦ������Ŀǰ��ѧ��̽������ȼ�������еļ���Ƚ����������ﻹԭΪ������ˮ����Ӧ����Ϊ��
CH4(g)+4NO2(g)��4NO(g)+CO2(g)+2H2O(g) ��H= ��574kJ��mol��1
CH4(g)+4NO(g)��2N2(g)+CO2(g)+2H2O(g) ��H= ��1160kJ��mol��1
�����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ ��
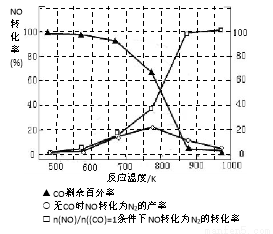
��5��ij�о�С����ʵ�����ԡ�Ag-ZSM-5��Ϊ��������ý�NOת��ΪN2��ת�������¶ȱ仯�����ͼ����ͼ����������ʹ��CO���¶ȳ���775K������NO��ת���ʽ��ͣ�����ܵ�ԭ��Ϊ ����n(NO)/n(CO)=1�������£�Ӧ���Ƶ�����¶��� ���ҡ�
��1����2�֣�1 ��2����2�֣���
��3����4�֣����� ��2�֣� 2NH3 �� 6e- + 6OH- = N2 +6H2O ��2�֡���ѧʽ1�֡���ƽ1�֣�
��4����3�֣�CH4(g)+2NO2(g)��CO2(g)��2H2O(g)+N2(g) ��H����867kJ/mol ������ʽ2�֣�
��H��ֵ1�֣�
��5����5�֣��÷�Ӧ�Ƿ��ȷ�Ӧ��1�֣�������775K��Ӧ�ﵽƽ�����������¶ȣ�1�֣���ƽ�����棨�����ƶ���NOת���ʽ��ͣ�1�֣� 870K��2�֡�д860-875K֮��������ֵ�����֣�
��������
�����������1�����ݡ�����ʽ�����м��㣺CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
��ʼŨ�ȣ�mol?L?1�� 0.2 0.3 0 0
ת��Ũ�ȣ�mol?L?1�� 0.12 0.12 0.12 0.12
ƽ��Ũ�ȣ�mol?L?1�� 0.08 0.18 0.12 0.12
ƽ�ⳣ��K=0.12��0.12�£�0.08��0.18��=1��
��2����Ϊ�÷�Ӧ��H<0��Ϊ���ȷ�Ӧ�������¶����ߣ�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С��T1 ��ƽ�ⳣ������300��ʱƽ�ⳣ��������T1 < 300�档
��3��ȼ�ϵ���У�O2Ϊ������ȼ��Ϊ����������ͨ�백���ĵ缫�Ǹ�����NH3ʧȥ�������ɵĵ���ΪN2�����Ե缫����ʽΪ��2NH3 �� 6e- + 6OH- = N2 +6H2O
��4��NO2����ԭΪN2����CH4������ΪCO2��д����ѧ����ʽ����ƽ��CH4(g)+2NO2(g)��CO2(g)��2H2O(g)+N2(g)�����ݸ�˹��������ʱ䣬��H=1/2��H1+1/2��H2=��867kJ?mol?1���ɵ��Ȼ�ѧ����ʽ��
��5��0~775K��Ϊ��Ӧ������ѧƽ��Ĺ��̣�775Kʱ�ﵽƽ�⣬�¶ȼ������ߣ�NO��ת���ʼ�С��˵������ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�����淴Ӧ�����ƶ���
���㣺���⿼��ƽ�ⳣ�����жϼ����㡢ȼ�ϵ��ԭ�����Ȼ�ѧ����ʽ����д����ѧƽ���ƶ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ������У���ϵ��в��ԣ�һ����ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ��������Ʊ�����ȷ����
A��������ĵ��뷽��ʽ��H2SO3 2H+��SO32-
2H+��SO32-
B����Ȳ�ķ��ӽṹģ��ʾ��ͼ��
C��H2O2�ĵ���ʽ��
D�� ������3-��-1-����
������3-��-1-����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ�Ͼ��С��γ��и�����һ��ģ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£����и���������ָ����Һ��һ���ܴ����������
A�������̪�Ժ�ɫ����Һ��Na+��Mg2+��NO3����HSO3��
B��0.1 mol��L��1 Fe(NO3)2��Һ��H+��Al3+��SO42����Cl��
C��0.1 mol��L��1��ˮ��Һ��K+��Na+��NO3����AlO2��
D����ˮ�������c(H+)=10��11mol��L��1����Һ��Ca2+��NH4+��Cl����HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡï���и����ڶ��θ߿�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
�״���һ����;�㷺�Ļ���ԭ�ϡ�
��1����ҵ�ϳ����������ַ�Ӧ�Ʊ��״���
��CO(g) + 2H2(g)  CH3OH(g) ��H1= -90��1KJ/mol
CH3OH(g) ��H1= -90��1KJ/mol
��CO2(g)�� 3H2(g)  CH3OH(g) + H2O(l) ��H2
CH3OH(g) + H2O(l) ��H2
��֪��CO(g)+ H2O (g) �� CO2 (g) + H2 (g) ��H3=-41��1 KJ/mol ��
H2O (l) ��H2O (g) ��H4=+44��0KJ/mol ��
��H2��
��2��ʵ����ģ����CO��H2��Ӧ���Ƽ״�����250���£���һ������CO��H2Ͷ��10L���ܱ������У������ʵ����ʵ���Ũ��(mol?L-1)�仯���±���ʾ����ǰ6minû�иı�������
| 2min | 4min | 6min | 8min | �� |
CO | 0��07 | 0��06 | 0��06 | 0��05 | �� |
H2 | x | 0��12 | 0��12 | 0��2 | �� |
CH3OH | 0��03 | 0��04 | 0��04 | 0��05 | �� |
��x= ��
��250��ʱ�÷�Ӧ��ƽ�ⳣ��KֵΪ�� (���ػ���)��
����6min��8minֻ�ı���ijһ���������ı�������� ��
�ܵ�8minʱ,�÷�Ӧ�Dz��Ǵﵽƽ��״̬ ��(��ǡ����ǡ�)
�ݸúϳɷ�Ӧ���¶�һ�������240��270�棬ѡ����¶ȵ�ԭ���ǣ����¶��µĴ������Ըߣ��� ��
��3�����״�ˮ��Һ������ŵ�����Ҫ�ĵ�ѹ�ͣ������Ƶõ������ȵ����ͬ���ʵ�����ˮ�ࡣд�����״�ˮ��Һ�ķ�ӦʽΪ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡï���и����ڶ��θ߿�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������в���ȷ���ǣ�
A�������ĵ绯ѧ��ʴ�Ȼ�ѧ��ʴ�ձ�
B�������ڸ�������ﲻ��ʴ
C��������í���������壬�����ױ���ʴ
D��������ʴ�ı�����M-ne-=Mn+�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����и�������һ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯����ͼ����֪W��һ�ֺ��ص�������Ϊ18��������Ϊ10��X��Neԭ�ӵĺ�����������1��Y�ĵ�����һ�ֳ����İ뵼����ϣ�Z�ķǽ�������ͬ����Ԫ������ǿ������˵����ȷ����

A����Ӧ�����Ӱ뾶��X��W
B����Ӧ��̬�⻯����ȶ���Y��Z
C��������XZW�Ⱥ����Ӽ����ֺ����ۼ�
D��Y������������Z���⻯���X������������Ӧ��ˮ�������Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����и����ڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l)ʮ3O2(g)=2CO2(g)+4H2O(g) ��H= ��1275.6 kJ��mol��1
�� H2O(l)=H2O(g) ��H=+ 44.0 kJ.mo��1
д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ ��
�����ᣨH3PO4����ˮ��Һ�и��ִ�����ʽ���ʵ�����������pH�ı仯��������ͼ��
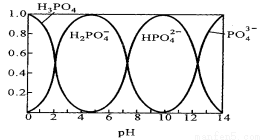
��1����Na3PO4��Һ�У�c��Na������c��PO43���� 3�������������������������Na3PO4��Һ�е���ϡ����� ��pH��10���͵�5�Ĺ����з�������Ҫ��Ӧ�����ӷ���ʽΪ ��
��2����ͼ���ƶ�NaH2PO4��Һ�и�����Ũ�ȴ�С��ϵ��ȷ���� ������ѡ����ĸ��
A��C��Na+���� C��H2PO4 -���� C��H+���� C��HPO4 2-���� C��H3PO4 ��
B��C��Na+���� C��H2PO4 -���� C��OH-���� C�� H3PO4���� C��HPO4 2- ��
C��C(H+)+ C(Na+)��C(OH-)+C(H2PO4��)+2C(HPO42��)��3C(PO43��)��C��H3PO4 ��
D��C(Na+)��C(H2PO4��)+C(HPO42��)��C(PO43��)��C��H3PO4 ��
��3������25�������²��0.1 mol��L�C1��Na3PO4��Һ��pH��12 �����Ƽ����Na3PO4�ĵ�һ��ˮ���ˮ�ⳣ��Kh ��д��������̣�����Na3PO4�ĵڶ���������ˮ�⣬���������λ��Ч���֣���
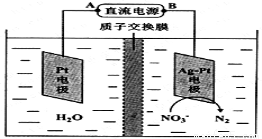
��ѧ�ڻ�������������ʮ����Ҫ�����ã��绯ѧ���ⷨ��������������ˮ�е���������Ⱦ���绯ѧ����NO3����ԭ����ͼ��ʾ����Դ����Ϊ ����A��B����������ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ��Զ�и���4��ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
Ԫ�ؼ��仯����ḻ���������磬����˵����ȷ����
A��ͭ�����Ũ�����л�ۻ�������ͭ�������Ũ����������������
B��NaOH��Һ��AlCl3��Һ��μӵ�����ͬ
C�������ȷǽ�����ʧ���ӣ����Խ��������û��ǽ��������ǽ��������û�����
D��Al����ˮ��Ӧ���ѣ��ʻ����Բ���Al�Ľ������κ������¾�������H2O������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����б�ҵ���ۺϲ��ԣ��������ۻ�ѧ�Ծ��������棩 ���ͣ������
��1��ij��ȤС����ʵ����̽����ҵ�ϳ�����Ļ�ѧԭ����
�ٰ��Ĵ�������ͼa��̽�����Ĵ������ļ���װ�ã�ʵ���й۲쵽��ƿ�в�˿���ֺ��ȣ��к���ɫ�������ɻ���̲��������̵ijɷ��� ���ѧʽ����
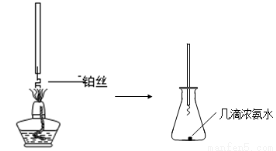
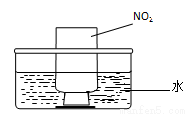
ͼa ͼb
��NO2�����գ���ͼb��ʾ����һƿNO2������ˮ���У���ˮ���ƿ�����Ƭ���ɹ۲쵽�������� ��
��2������������Һ��Fe3+ˮ������ػ�ɫ������Fe(NO3)3��ҺΪ�������ʵ��̽��Ӱ������ˮ��̶ȵ����ء�
��д��Fe(NO3)3ˮ������ӷ���ʽ ��
�ڲ���ʾ������±�ʵ�鷽������ơ�
��ѡ���ϣ�0.05mol?L-1Fe(NO3)3��0.5mol?L-1Fe(NO3)3��1.0mol?L-1HNO3��1.0mol?L-1NaOH��NaHCO3���塢����ˮ����ˮ����pH�Ƽ���������������
����Ӱ������ | ʵ����� | Ԥ������ͽ��� |
��Һ������� | ȡ����0.5mol?L-1Fe(NO3)3���Թ��У����뼸��1mol?L-1HNO3�� | �ػ�ɫ��Һ��ɫ��dz��˵����Һ������ǿ������Fe(NO3)3��ˮ�⡣ |
�ε�Ũ�� |
|
|
|
|
|
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com